
Anvisa participa da 18ª Reunião Anual da ICCR
No período de 9 a 11 de julho, a Anvisa participou da 18ª Reunião Anual da Cooperação Internacional em Regulação de Cosméticos (Internacional Cooperation on Cosmetics Regulation – ICCR), em Taipé Chinesa, Taiwan. A ICCR é um fórum internacional constituído voluntariamente por autoridades reguladoras de cosméticos, que compõem o Comitê Gestor, cujas jurisdições são Brasil, Canadá, Estados Unidos, Israel, Japão, República da Coreia, Taipé Chinesa e União Europeia.
A Reunião Anual da ICCR-18 contou com ampla participação, reunindo representantes de doze jurisdições, dentre as autoridades reguladoras de cosméticos membros e observadores (Arábia Saudita, Egito, Reino Unido e Tailândia), além de representantes das associações de indústrias de cosméticos, incluindo a Associação Brasileira da Indústria de Higiene Pessoal, Perfumaria e Cosméticos (Abihpec), presencialmente.
A presidente da ICCR-18, posição atualmente ocupada pela autoridade Taiwan Food and Drug Administration (TFDA), conduziu as discussões junto ao Comitê Gestor, que promoveu atualização em cinco documentos, a saber: “Requisitos para Presidir um Ciclo da ICCR”, “Processo para Observador Fazer a Transição para Membro do Comitê Gestor da ICCR”, “Procedimentos Operacionais Padrão do ICCR”, “Anexo do Relatório de Padrões Internacionais em Cosméticos” e “Inventário de Métodos Alternativos ao Uso de Animais Validados Aplicáveis a Produtos Cosméticos e seus Ingredientes em Todas as Regiões da ICCR”.
Durante a reunião, foi realizada uma apresentação dos estudos conduzidos durante o ciclo da ICCR-18 pelo Grupo de Trabalho de Estratégias Integradas para Avaliações de Segurança de Ingredientes Cosméticos e pelo Grupo de Trabalho de Comunicações ao Consumidor. Para o ciclo ICCR-19, o Comitê Gestor decidiu pela criação de um novo Grupo de Trabalho sobre Considerações para Rotulagem Eletrônica em Cosméticos.
Na tarde do dia 11/7, a Associação da Indústria de Cosméticos de Taiwan (Taiwan Cosmetics Industry Association – TWCIA) organizou, em parceria com a TFDA, o Simpósio sobre a Transformação e a Inovação na Indústria de Cosméticos, no qual foram apresentadas iniciativas de sustentabilidade promovidas pelo setor industrial de cosméticos.
O Brasil foi representado no encontro pela Gerência de Produtos de Higiene, Perfumes, Cosméticos e Saneantes e pela Assessoria de Assuntos Internacionais da Anvisa, que apresentaram as atualizações regulatórias ocorridas entre julho de 2023 e junho de 2024, com destaque para publicação do Manual para Regularização de Protetores Solares.
A próxima reunião presencial do fórum internacional, a ICCR-19, será realizada na cidade de Ottawa, no Canadá, em julho de 2025.
Sobre a ICCR
Os membros da ICCR realizam intercâmbio de experiências e alinhamento de requisitos de segurança para produtos cosméticos, de perfumaria e de higiene pessoal, a fim de maximizar a proteção ao consumidor e contribuir para diminuir as barreiras regulatórias ao comércio internacional. As discussões ocorrem em reuniões do Comitê Gestor e de grupos de trabalho criados para tratar de temas específicos. O fórum internacional também é uma importante plataforma de diálogo com as associações industriais, reguladores de jurisdições que desejam participar como observadoras e outros grupos interessados. Participantes da reunião da ICCR em Taiwan.
Tags: cosméticos regulação ICCR cooperação internacional autoridades reguladoras
Fonte: Site da ANVISA
Read More
Anvisa aprova projeto-piloto para bula digital de medicamentos
Os diretores da Anvisa aprovaram, na reunião pública desta quarta-feira (10/7), um projeto-piloto para implementação da bula digital de medicamentos no Brasil.
Segundo o diretor relator, Daniel Pereira, a proposta caminha na direção da modernização e da transformação digital no setor da saúde, e está alinhada com uma tendência mundial. “Essa é uma oportunidade para aprimorar a acessibilidade e a personalização das informações de saúde”, afirmou. De acordo com o relator, não haverá nenhuma redução de direitos aos consumidores. Veja o voto completo do diretor.
O projeto terá vigência até 31 de dezembro de 2026. As informações coletadas e monitoradas durante esse período devem servir como subsídio para a futura regulamentação definitiva sobre o tema.
O que é a bula digital?
A bula digital é uma versão eletrônica da bula de medicamento. Ela pode ser acessada pela leitura, nas embalagens, de um código de barras bidimensional (QR Code). A bula digital também permite o acesso a informações adicionais, como vídeos, áudios e outras instruções que ajudem no uso adequado do medicamento.
Para quais tipos de medicamentos a bula digital será permitida?
| Tipo de medicamento | Justificativa resumida |
| Embalagens de amostras grátis de medicamentos | A entrega das amostras grátis só pode ser feita pelo profissional de saúde ao paciente durante consulta, com a devida prescrição de uso e orientações pertinentes a cada tratamento. |
| Medicamentos com destinação a estabelecimentos de saúde, exceto farmácias e drogarias | De venda permitida em hospitais, clínicas, ambulatórios e serviços de atenção domiciliar, por exemplo, foram selecionados por serem utilizados sob supervisão de profissionais de saúde. |
| Medicamento isento de prescrição (MIP), comercializados em embalagens múltiplas | São produtos de baixo risco e que, segundo a legislação atual, já podem ser disponibilizados nas gôndolas das farmácias, em embalagens primárias (por exemplo, blister ou cartela de comprimidos), sem o acompanhamento de bulas. Caso o consumidor queira a bula física, pode solicitar ao estabelecimento. |
| Medicamentos com destinação governamental, acondicionados em embalagens que contenham as marcas governamentais próprias do Ministério da Saúde | A legislação vigente já isenta, em um grande percentual, a obrigatoriedade de bulas impressas nas embalagens. Da mesma forma que os MIPs, já existe redução considerável na disponibilização de bula física, nos termos da RDC 769, de 12 de dezembro de 2022. |
E a bula impressa, como fica?
Em todos os casos, as bulas impressas devem ser oferecidas caso sejam solicitadas pelos pacientes ou profissionais de saúde.
A norma aprovada prevê também que os estabelecimentos que comercializam medicamentos informem aos consumidores, em comunicação visual, a possibilidade de solicitar a bula impressa, com a frase abaixo:
“Atenção: Este estabelecimento dispensa medicamentos com bula digital! Você pode acessá-la online. Caso prefira, solicite a bula impressa a um de nossos atendentes.”
Veja aqui a sugestão do modelo de cartaz.
Saiba mais
A discussão sobre a bula digital surgiu a partir da publicação da Lei 14.388/22, que prevê que a autoridade sanitária pode definir quais medicamentos terão apenas um formato de bula.
A proposta aprovada pela Anvisa passou por consulta pública em 2023. Todos os materiais relacionados podem ser acessados na página da Consulta Pública 1.224/2023. Veja abaixo o histórico completo do processo regulatório:
- 2022: Inclusão do tema na Agenda Regulatória 2024-2025: Tema 8.29 – Revisão das regras para elaboração, harmonização, atualização, publicação e disponibilização de bulas de medicamentos para pacientes e para profissionais de saúde.
- 2022: Abertura do processo regulatório para discussão sobre a implementação da bula digital e outras informações eletrônicas.
- 2023: Consulta pública aprovada em 6/12/2023 e realizada de 20/12/2023 a 19/3/2024.
- 2024: Deliberação sobre a proposta de resolução em reunião pública da Diretoria Colegiada da Anvisa.
Confira o texto da RDC publicado no Diário Oficial da União desta sexta-feira (12/7). Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos projeto-piloto bula digital
Fonte: Site da ANVISA
Read More
Anvisa prorroga prazo de CP sobre classificação de risco de atividades econômicas
A Diretoria Colegiada da Anvisa, em reunião realizada nesta quarta-feira (10/7), decidiu prorrogar por mais 60 dias o período para recebimento de críticas e sugestões relacionadas à proposta de Resolução da Diretoria Colegiada (RDC) que trata da identificação e classificação do grau de risco das atividades econômicas sujeitas à vigilância sanitária.
A medida visa ampliar a participação da sociedade na definição das normas que regulamentarão o licenciamento, a inspeção, a fiscalização, o controle, o monitoramento e a educação sanitária de empreendedores e pessoas jurídicas.
A proposta abrange não apenas grandes empresas, mas também microempreendedores individuais, empreendimentos familiares rurais e empreendimentos econômicos solidários.
A Consulta Pública 1.249, iniciada em 2 de maio de 2024 e publicada no Diário Oficial da União de 6 de maio de 2024, está aberta para contribuições da sociedade, que poderão ser enviadas até a nova data estipulada pela Agência (9/9). Confira neste link todas as informações sobre a proposta e o formulário para envio de contribuições.
Esta iniciativa reflete o compromisso da Anvisa de assegurar a transparência e a participação pública no processo regulatório, promovendo assim um ambiente mais seguro e saudável para todos os envolvidos nas atividades econômicas reguladas pela vigilância sanitária no Brasil. Categoria
Saúde e Vigilância Sanitária
Tags: consulta pública atividades econômicas avaliação de risco
Fonte: Site da ANVISA
Read More
Anvisa aprova novo regulamento para registro de medicamentos biossimilares
A Anvisa aprovou, na reunião da Diretoria Colegiada desta segunda-feira (27/5), o novo regulamento para registro de medicamentos biossimilares.
O objetivo da nova norma é simplificar o processo de desenvolvimento desses produtos, a partir da flexibilização segura de requisitos. O regulamento irá possibilitar a dispensa de algumas etapas e estudos específicos, quanto tecnicamente viável, promovendo assim um ambiente regulatório transparente e previsível ao setor.
Os pontos e requisitos para a comprovação da comparabilidade entre os produtos foram exaustivamente discutidos durante o processo regulatório. Uma das novidades do novo regulamento é a possibilidade de utilização de medicamento de referência comparador adquirido em território internacional em situação de indisponibilidade e comprovados os requisitos técnicos necessários.
A norma hoje aprovada traduz o reconhecimento da Anvisa à importância do acesso dos pacientes aos produtos biológicos, já que a utilização dos biossimilares é uma estratégia de saúde pública importante para diminuir os custos dos medicamentos e aumentar a acessibilidade aos produtos biológicos e às novas tecnologias, com segurança e eficácia.
Processo regulatório
A nova regulamentação é resultado de estudos iniciados em 2022, com a publicação do Edital de Chamamento 15/2022, que colheu importantes informações e subsídios para o desenvolvimento de produtos biológicos pela via da comparabilidade.
Após o Edital, a Anvisa realizou um Diálogo Setorial com a sociedade civil, em 31 de julho do ano passado, que permitiu mais uma coleta de informações para a abertura do processo regulatório.
A norma foi construída de forma transparente, com grande participação da sociedade civil nas discussões desde o início do processo, por meio do Edital de Chamamento, Diálogo Setorial e Consulta Pública, etapas essenciais para o entendimento e a melhoria da proposta regulatória.
A Anvisa é uma das primeiras agências reguladoras a adequar o marco regulatório harmonizado internacionalmente com as principais agências reguladoras do mundo. A nova regra é resultado de um movimento mundial de adequação do marco regulatório para biossimilares, que teve sua importância ressaltada por todos os diretores da Agência para a ampliação do acesso a medicamentos biológicos.
Veja o voto da diretora supervisora Meiruze de Sousa Freitas.
Veja o voto do diretor relator Antonio Barra Torres.
Fonte: Site da ANVISA
Read More
Anvisa aprova Sistema Nacional de Controle de Receituário
A Diretoria Colegiada da Anvisa aprovou, nesta segunda-feira (27/5), uma norma que institui o Sistema Nacional de Controle de Receituário (SNCR).
O objetivo da medida é aprimorar a concessão e o controle das numerações das Notificações de Receita utilizadas para a prescrição de medicamentos e produtos sujeitos a controle especial (medicamentos controlados).
Como o sistema irá funcionar?
A Anvisa irá disponibilizar, para as autoridades sanitárias (Vigilâncias Sanitárias), uma plataforma on-line que irá fornecer uma numeração que deve ser utilizada nas Notificações de Receita pelos prescritores.
A numeração virá de um banco único para todo o país. Isso porque, desde a publicação da Lei 13.732/2018, as receitas passaram a ter validade em todo o território nacional, independentemente da unidade da federação em que tenham sido emitidas.
As Vigilâncias Sanitárias continuarão responsáveis pela concessão e pelo controle das numerações, como já é feito atualmente. Agora, porém, será possível contar com o auxílio da ferramenta on-line para gerenciar os números de forma automatizada, a partir de um banco único nacional.
O SNCR irá aprimorar o controle sobre os receituários e numerações, uma vez que será possível identificar a origem de todas as notificações de receita. A medida irá trazer mais segurança ao farmacêutico no momento da dispensação do medicamento e evitar a ocorrência de fraudes e falsificações.
Atenção: o sistema não será uma plataforma de emissão de prescrições eletrônicas, mas apenas de fornecimento e controle da numeração.
Desenvolvimento e cronograma
O sistema foi desenvolvido e testado com a participação de representantes de autoridades sanitárias indicados pelo Grupo de Trabalho da Vigilância Sanitária, coordenado pela Anvisa. Além disso, a proposta de norma passou pela Consulta Pública 588/2018, além de consultas dirigidas junto ao Sistema Nacional de Vigilância Sanitária (SNVS).
Assim que o SNCR for disponibilizado pela Agência, as autoridades sanitárias que desejarem poderão começar a utilizá-lo para a emissão de novas numerações, ou seja, ainda em 2024. A partir de 1º de janeiro de 2025, o uso do sistema será obrigatório para todas as Vigilâncias Sanitárias.
Para a implementação do SNCR, a Anvisa irá realizar treinamentos e capacitações junto às Vigilâncias Sanitárias estaduais e do Distrito Federal (DF), por meio de webinares e reuniões específicas, além da publicação de um manual sobre o tema no portal da Agência.
Os talonários de receituários impressos até 1º de janeiro de 2025 que não contenham a numeração emitida pelo SNCR poderão ser entregues pela autoridade sanitária competente por até dois anos. Ou seja, haverá um prazo de transição para a substituição gradual das numerações emitidas por cada estado e pelo DF pela numeração única fornecida pelo SNCR.
Neste momento, não há modificações dos procedimentos para os prescritores solicitarem suas numerações ou talonários de Notificação de Receita. Assim, devem ser seguidos os mesmos procedimentos já estabelecidos nas Portarias SVS/MS 344/1998 e 06/1999, e nas orientações complementares definidas pelas Vigilâncias Sanitárias locais.
Sobre os produtos controlados
A Portaria SVS/MS 344/1998 é a norma sanitária que dispõe sobre as medidas de controle para substâncias entorpecentes, precursoras, psicotrópicas e outras sob controle especial. São consideradas substâncias sujeitas a controle especial no Brasil aquelas listadas no Anexo I da referida Portaria. A legislação sanitária estabelece diferentes tipos de receituários controlados aplicáveis aos medicamentos, a depender da sua classificação na norma em questão.
Compete aos estados, aos municípios e ao Distrito Federal exercer a fiscalização e o controle dos atos relacionados à produção, à comercialização e ao uso das substâncias constantes das Listas da Portaria SVS/MS 344/1998, bem como dos medicamentos que as contenham, no âmbito de seus territórios, e, ainda, fazer cumprir as determinações da legislação federal pertinente e da Portaria.
A autoridade sanitária local é responsável por fornecer ao profissional ou instituição hospitalar, devidamente cadastrado, o talonário de Notificação de Receita A (NRA) e o talonário de Notificação de Receita Especial para Talidomida, e a numeração para a confecção dos talonários de Notificação de Receita B e B2 e de Notificação de Receita Especial para Retinoides de uso sistêmico.
A necessidade de controle destes medicamentos e dos receituários se justifica pelos riscos apresentados por essas substâncias, visto que a Portaria abrange substâncias psicoativas, analgésicas, anestésicas, teratogênicas, entre outras. Além disso, devido às suas propriedades, tais medicamentos apresentam potencial de causar dependência e de serem utilizados de forma abusiva ou indevida. Devido a essas características, é importante que os prescritores sejam conhecidos pelas autoridades sanitárias e que os receituários possuam rastreabilidade.
Outra razão para que haja esse controle é que essas substâncias e medicamentos apresentam alto potencial de desvio para uso ilícito, motivo pelo qual se enquadram no conceito de droga definido pela Lei 11.343/2006, que estabelece normas para repressão à produção não autorizada e ao tráfico ilícito de drogas, entre outras.
Categoria
Saúde e Vigilância Sanitária
Fonte: Site da ANVISA
Read More
Acompanhe a Reunião Pública da Diretoria Colegiada desta quinta-feira
Os diretores da Anvisa se reúnem, nesta quinta-feira (04/04), para a quinta reunião pública da Diretoria Colegiada (Dicol) de 2024. O encontro acontece a partir das 10h por videoconferência e será transmitido ao vivo pelo canal da Agência no YouTube.
Na pauta, está proposta de portaria sobre a estrutura de governança da Anvisa para a harmonização e internalização de temas desenvolvidos no âmbito do Conselho Internacional para Harmonização de Requerimentos Técnicos para Produtos Farmacêuticos de Uso Humano (ICH).
Também estão previstos julgamentos de recursos administrativos. Veja aqui a pauta completa.
Data: 04/04/2024
Horário: 10h
Local: a reunião será realizada por meio de videoconferência
Acompanhe pelo Youtube.Categoria
Saúde e Vigilância Sanitária
Tags: dicol
Fonte: Site da ANVISA
Read More
CMED autoriza ajuste de preços de medicamentos para 2024
Reajuste de preços dos medicamentos é o menor valor praticado desde 2020 e está autorizado a partir do dia 31 de março.
A Câmara de Regulação do Mercado de Medicamentos (CMED) autorizou o ajuste anual dos preços de medicamentos no Brasil, a partir do próximo domingo, dia 31 de março.
A Resolução CM-CMED 1/2024, desta quinta-feira (28/3), foi aprovada pelo Conselho de Ministros da Câmara e estabeleceu três níveis de reajuste:
- Nível 1: 4,50% (quatro inteiros e cinquenta centésimos por cento);
- Nível 2: 4,50% (quatro inteiros e cinquenta centésimos por cento); e
- Nível 3: 4,50% (quatro inteiros e cinquenta centésimos por cento).
Esse é o menor valor praticado desde 2020. Destaca-se que o percentual não é um aumento automático nos preços, mas uma definição de teto permitido de reajuste.
Os três níveis visam discriminar os mercados concentrados dos moderadamente concentrados e dos concorrenciais, conforme metodologia constante da Resolução CMED 01/2015.
Entenda o cálculo do reajuste
A Lei 10.742/2003, que é a base do marco regulatório do mercado de medicamentos, prevê o reajuste anual dos preços de medicamentos baseado no modelo de regulação por teto de preços (price cap). Esse modelo prevê a aplicação de um índice geral de preços, um fator de produtividade (X) e dois fatores de ajustes de preços, um entre setores (Y) e o outro intrassetorial (Z).
O índice geral de preços utilizado é o Índice de Preços ao Consumidor Amplo (IPCA), calculado pelo Instituto Brasileiro de Geografia e Estatística (IBGE). O período de observação para efeitos de cálculo do reajuste considera o IPCA acumulado nos 12 meses anteriores à data do cálculo, no caso, março de cada ano.
A segunda variável do modelo é um fator de produtividade que permite repassar ao consumidor os ganhos estimados de produtividade do setor farmacêutico (Fator X). A terceira variável, o Fator Y, tem como objetivo ajustar os preços relativos entre o setor farmacêutico e os demais setores da economia, para minimizar o impacto dos custos não administráveis nas empresas do setor farmacêutico.
Por último, o fator de ajuste de preços relativos intrassetoriais (Fator Z) é o mecanismo inserido no cálculo do ajuste de preços com o intuito de diminuir o poder de mercado das empresas que produzem medicamentos de classes terapêuticas com baixa contestabilidade, incentivando a competição no setor.
Fórmula do ajuste
O reajuste de preços dos medicamentos é estabelecido de acordo com a fórmula VPP = IPCA – X + Y + Z, sendo que:
- VPP é a variação percentual no preço;
- IPCA é o índice de preços ao consumidor, calculado pelo IBGE;
- X é o fator de produtividade repassado ao consumidor, calculado pela Secretaria de Reformas Econômicas do Ministério da Fazenda (SRE/MF);
- Y é o fator de ajuste de preços entre setores, calculado pela SRE/MF; e
- Z é o fator de ajuste de preços intrassetor, estipulado pela Secretaria Executiva da Câmara de Regulação do Mercado de Medicamentos (SCMED) e calculado em função do fator X.
Destaca-se que o ajuste anual de preços decorre de mandamento legal expresso contido na Lei 10.742/2003, cabendo à CMED somente operacionalizá-lo, com base em critérios técnicos e na metodologia exposta acima.
Todos os documentos que referenciam os cálculos do ajuste anual de preços de medicamentos estão disponíveis em https://www.gov.br/anvisa/pt-br/assuntos/medicamentos/cmed/ajuste-anual-de-precos-de-medicamentoCategoria
Saúde e Vigilância Sanitária
Tags: preço de medicamentos reajuste anual cmed
Fonte: Site da ANVISA
Read More
Esclarecimentos sobre a transparência das filas de análise na Anvisa
Aumento no volume de processos priorizados tem impactado as filas.
Recentemente, a área de Medicamentos da Anvisa recebeu alguns questionamentos sobre o ritmo das filas de análise de medicamentos genéricos e similares. Em resposta, a Agência reitera seu compromisso primordial de garantir a segurança, a eficácia e a qualidade dos produtos submetidos à sua análise.
Destaca-se o contínuo esforço para aprimorar os sistemas e procedimentos da Anvisa, visando mais eficiência e transparência em suas atividades. Como exemplo, temos a publicação recente de um painel detalhando as filas internas de cada unidade organizacional envolvida na avaliação de estudos necessários para o registro de medicamentos sintéticos e semissintéticos. Além disso, foi disponibilizado um relatório de gestão ao público, demonstrando a evolução das análises e dos pedidos de registros recebidos pela Agência.
Apesar disso, ainda é relevante contextualizar o aumento significativo no volume de processos priorizados, especialmente na categoria de genéricos, que tem impactado diretamente as análises de pedidos não priorizados de medicamentos genéricos e similares. Embora avanços notáveis tenham sido alcançados na regularização desses casos prioritários, o crescente volume de solicitações dessa natureza tem sobrecarregado os recursos disponíveis para a análise de outros processos. Confira abaixo dois gráficos que ajudam a visualizar a situação.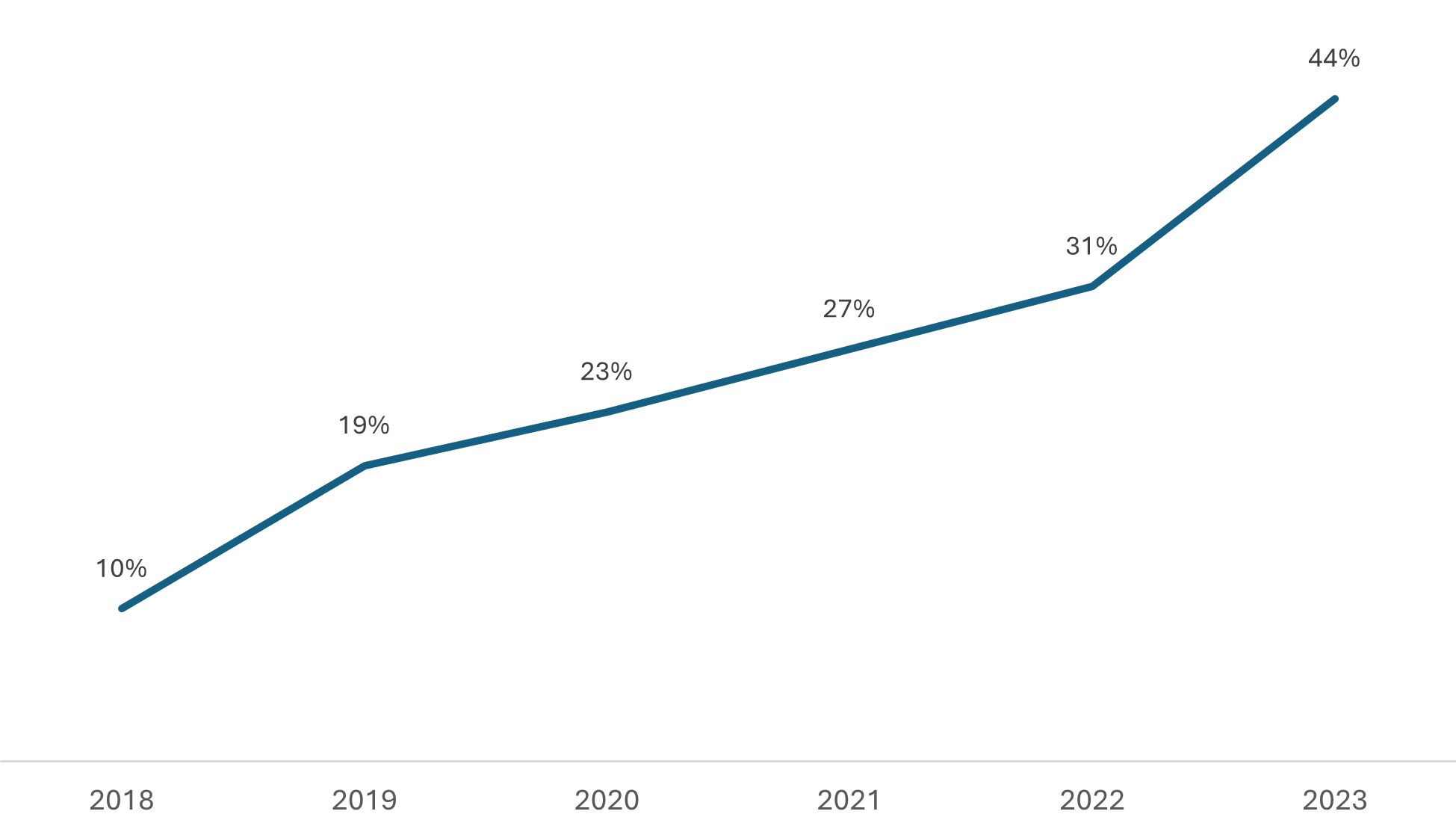 Ocupação da Capacidade de Análise da Gerência de Avaliação da Qualidade de Medicamentos (GQMED) com Processos Priorizados, considerando os recursos humanos atualmente disponíveis.
Ocupação da Capacidade de Análise da Gerência de Avaliação da Qualidade de Medicamentos (GQMED) com Processos Priorizados, considerando os recursos humanos atualmente disponíveis.
O Gráfico 1 mostra a ocupação da capacidade de análise da Gerência de Qualidade em Medicamentos (GQMED) com processos de genéricos priorizados ao longo do tempo.
Observa-se a variação na carga de trabalho e como isso tem afetado a capacidade de análise da GQMED. 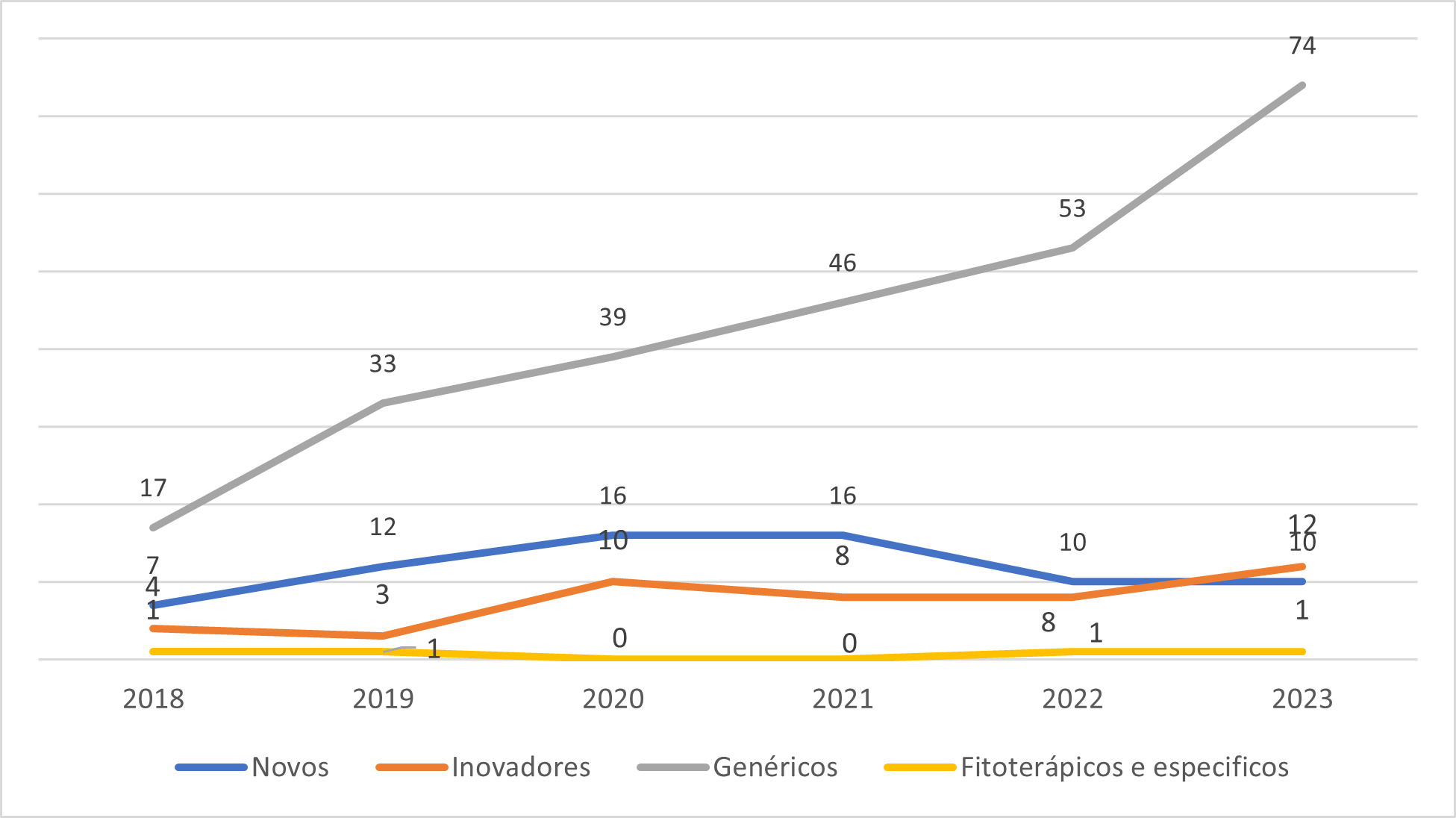 Evolução dos Pedidos de Registros de Medicamentos que tiveram análises priorizadas nos termos das Resoluções RDC 204 e 205, ambas de 2017.
Evolução dos Pedidos de Registros de Medicamentos que tiveram análises priorizadas nos termos das Resoluções RDC 204 e 205, ambas de 2017.
O Gráfico 2 ilustra a evolução dos pedidos de priorização de todos os registros de medicamentos sintéticos e semissintéticos. Destaca-se o aumento significativo na demanda por priorização, especificamente de medicamentos genéricos, o que tem impactado diretamente a dinâmica das análises realizadas pela Anvisa. Esse incremento acentuado também foi observado no ano de 2024, no qual o volume de processos de genéricos priorizados já representa 60% do total previsto para ser analisado no primeiro trimestre.
Portanto, se não houver aumento no número de técnicos responsáveis pelas análises e se for mantido o ritmo de crescimento, que em análise inicial indica um direcionamento da indústria para esse nicho de genéricos priorizados, é esperado que a velocidade de início das análises dos pedidos de registros de medicamentos genéricos e similares não priorizados continue diminuindo.
Por fim, a Anvisa reitera seu compromisso em atuar de forma diligente e responsável na análise dos processos, sempre visando o interesse público e a segurança dos cidadãos.
Esta notícia está clara para você? Clique aqui e responda nossa pesquisa em menos de 1 minuto. Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos filas de análise genéricos similares registro
Fonte: Site da ANVISA
Read More
Webinar apresenta nova norma de dispositivos médicos para diagnóstico in vitro
A Anvisa irá realizar uma videoconferência (webinar) sobre a RDC 830/2023, que trata dos requisitos para regularização de dispositivos médicos para diagnóstico in vitro (IVD). A norma entra em vigor no dia 1º de junho de 2024.
No webinar, serão apresentadas as principais mudanças em relação ao regulamento técnico vigente (RDC 36/2015), as informações sobre reclassificação de produtos, as orientações sobre como proceder, além dos prazos de adequação.
Para participar da atividade, basta clicar no link abaixo, no dia e horário agendados. Não é preciso fazer cadastro prévio.
Dia 11/3, às 10h – Webinar RDC 830/23 – Novo regulamento técnico de dispositivos médicos IVD.
Webinar
É um seminário virtual que tem como objetivo fortalecer as iniciativas de transparência da Anvisa, levando conteúdo e conhecimento atualizado ao público. A transmissão é via web e a interação com os usuários é feita em tempo real, por um chat realizado durante o evento.
Confira a página específica de webinares realizados pela Agência.
Esta notícia está clara para você? Clique aqui e responda nossa pesquisa em menos de 1 minuto. Categoria
Saúde e Vigilância Sanitária
Tags: webinar videoconferência dispositivos médicos diagnóstico in vitro
Fonte: Site da ANVISA
Read More
Segurança da informação: esclarecimento sobre a recomendação de troca de senha
Em 29 de fevereiro de 2024, a Equipe de Tratamento a Incidentes em Redes e Segurança Cibernética (Etir) da Anvisa emitiu um e-mail onde recomenda que os usuários de sistemas externos da Agência, como o Solicita, Notivisa, Peticionamento, SNGPC etc., alterem imediatamente suas senhas de acesso.
Cabe esclarecer que não houve uma ação concreta de invasão aos sistemas, e o objetivo da comunicação é tão somente fortalecer as medidas de segurança implementadas no ambiente da Anvisa.
Atualmente, uma das maiores vulnerabilidades enfrentadas pelas organizações é o comprometimento das credenciais de acesso, seja por meio de phishing (tentativa de fraude para obter informações confidenciais), engenharia social (técnica de manipulação psicológica que explora o erro humano para obter informações privadas) e outras formas de ataques direcionados.
Nesse cenário cada vez mais complexo e interconectado da segurança da informação, estratégias proativas de monitoramento de credenciais e ações preventivas desempenham um papel fundamental na redução de riscos e na garantia da integridade, confidencialidade e disponibilidade das informações.
Em vista desse contexto, reforçamos a importância de seguir as boas práticas de segurança ao definir a nova senha, garantindo a inclusão de letras maiúsculas e minúsculas, número(s) e caracter(es) especial(is), conforme orientado no referido e-mail.
Para realizar a alteração da senha, acesse o Sistema de Segurança (https://www1.anvisa.gov.br/segurancaLogin), realize o login normalmente com e-mail e a senha antiga, escolha a empresa/instituição a ser representada e clique em “Alterar Senha”.
Caso não consiga alterar a senha, pedimos que solicite a redefinição da senha, entrando em contato com a Central de Atendimento pelos canais abaixo:
– Telefone: https://www.gov.br/anvisa/pt-br/canais_atendimento/atendimento-por-telefone
– Webchat: https://www.gov.br/anvisa/pt-br/canais_atendimento/webchat
– Formulário Eletrônico: https://www.gov.br/anvisa/pt-br/canais_atendimento/formulario-eletronico
Lembramos ainda que, mesmo aqueles usuários que utilizem o login pelo Gov.br ou por certificado digital para acessar sistemas da Anvisa, e que tenham recebido o e-mail solicitando a troca de senha, devem fazer a alteração no Sistema de Segurança Externo (https://www1.anvisa.gov.br/segurancaLogin).Categoria
Saúde e Vigilância Sanitária
Tags: tecnologia da informação segurança cibernética sistemas externos troca de senha ações preventivas
Fonte: Site da ANVISA
Read More
