
Anvisa divulga dados do anuário sobre a indústria farmacêutica no Brasil
A Secretaria-Executiva da Câmara de Regulação do Mercado de Medicamentos (SCMED) divulgou a 6ª edição do Anuário Estatístico do Mercado Farmacêutico.
A publicação reúne dois grandes grupos de informações: um dedicado ao panorama do mercado farmacêutico em 2022 e outro com séries históricas entre 2020 e 2022.
O objetivo do anuário é oferecer, de forma racional e organizada, estatísticas sobre a indústria de fármacos no Brasil. Para traçar o perfil do mercado, o levantamento considerou dados consolidados até junho de 2023, extraídos dos relatórios de comercialização encaminhados pelas empresas, sobre produtos farmacêuticos regulados pela Câmara de Regulação do Mercado de Medicamentos (CMED), divididos em seis grupos distintos de fármacos: biológicos, específicos, genéricos, similares, novos e fitoterápicos.
A publicação traz uma ampla variedade de informações sobre a evolução do mercado farmacêutico, o faturamento anual obtido, os produtos comercializados, as características dos medicamentos, os canais de distribuição, as substâncias mais comercializadas, entre outras.
Para a elaboração do documento, foram utilizadas as informações disponíveis no Sistema de Acompanhamento do Mercado de Medicamentos (Sammed).
Dados gerais
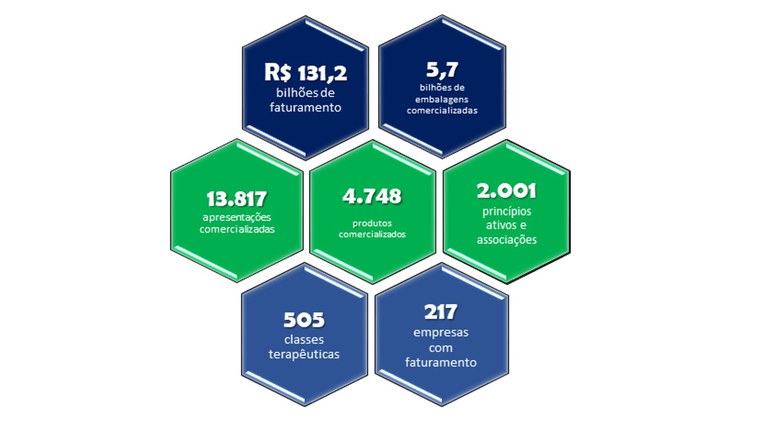
De acordo com as informações do anuário, a venda de medicamentos no Brasil gerou um faturamento de R$ 131,2 bilhões em 2022. Em termos percentuais, o faturamento do setor industrial farmacêutico brasileiro, cujo valor em 2021 era de R$ 135,2 bilhões, teve uma redução de cerca de 3%.
Quanto à quantidade de embalagens comercializadas, o setor encolheu mais de 5,8%, atingindo o volume de 5,7 bilhões de unidades em 2022, comparadas às 6 bilhões de unidades comercializadas em 2021.
O relatório revela também que, em 2022, foram identificados 4.748 produtos cadastrados e em comercialização no país. Destes, 40,9% eram medicamentos genéricos e 29,1%, similares. Portanto, similares e genéricos corresponderam a 70% do total de unidades comercializadas em 2022. Outros tipos de produtos representaram 30%.
O documento aponta que o faturamento dos medicamentos novos apresentou maior representatividade no mercado, somando mais de R$ 43,2 bilhões (33,9% do total), seguido dos medicamentos biológicos, que acumularam mais de R$ 34 bilhões (25,9% do total). Já os medicamentos similares alcançaram a terceira posição, com um faturamento de R$ 24,9 bilhões (19% do total), e os genéricos acumularam um faturamento de R$ 19,9 bilhões (15,1% do total).
Preços médios
O anuário destaca que o preço médio global de medicamentos praticado em 2022 foi de R$ 22,98 – os medicamentos biológicos atingiram, no ano passado, o valor médio de R$ 379,90, enquanto que os medicamentos novos e similares apresentaram preços médios praticados de R$ 45,62 e R$ 15,03, respectivamente. Os medicamentos genéricos tiveram preço médio de R$ 8,50, os fitoterápicos de R$ 4,81, enquanto o menor preço observado foi dos medicamentos específicos, de R$ 1,77.
Empresas, apresentações e princípios ativos
Segundo as informações do documento, o número de empresas que comercializaram medicamentos no Brasil passou de 234, em 2021, para 217, em 2022. Juntas, essas empresas venderam 13.817 apresentações de medicamentos, 1,1% a menos do que em 2021.
Com relação à quantidade de princípios ativos, matérias-primas envolvidas na produção de medicamentos, foram identificados um total de 2.001. O anuário informa também um montante de 505 classes terapêuticas comercializadas em 2022, quando em 2021 o total foi de 509. Essas classes terapêuticas são definidas conforme a ação do medicamento no organismo.
No que se refere à liderança do mercado, vale destacar que, no ranking das 20 maiores empresas independentes (não pertencentes a grupos econômicos), a Fundação Oswaldo Cruz (Fiocruz) figura em primeiro lugar entre as empresas independentes que mais faturaram em 2022 e o Instituto Butantan aparece em 7º lugar entre as 20 maiores empresas.
Série histórica
A série histórica entre 2020 e 2022 tornou possível uma melhor avaliação do comportamento desse mercado, considerando inclusive ser este o período que compreendeu a pandemia de Covid-19.
Em linhas gerais, pôde ser constatada a manutenção de um mercado vigoroso, que cresceu 20,4% em faturamento neste período, porém decresceu 25,8% no volume de embalagens comercializadas.
Confira abaixo um resumo do panorama geral do mercado farmacêutico em 2022.
Leia a íntegra da 6ª edição do Anuário Estatístico do Mercado Farmacêutico, com dados de 2022 e séries históricas de 2020 a 2022. Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos mercado farmacêutico anuário estatístico
Fonte: Site da ANVISA
Read More
Cooperação técnica: Anvisa e estado de São Paulo fazem acordo na área de farmacovigilância
O Acordo de Cooperação Técnica (ACT) na área de farmacovigilância com o Centro de Vigilância Sanitária do estado de São Paulo, vinculado à Secretaria de Estado da Saúde (SES-SP), foi assinado pela SES-SP em 4 de agosto. O extrato do acordo foi publicado no Diário Oficial da União (DOU) da última segunda-feira (7/8). A Anvisa já havia assinado o documento em 5 de maio. Faz parte do ACT um plano de trabalho, também já firmado.
Para celebrar a parceria, será realizado um evento no dia 21 de setembro, na sede da Agência, em Brasília. Posteriormente, serão divulgadas, aqui no portal, mais informações a respeito, como horários e programação completa.
Teor do acordo
Com prazo de vigência de cinco anos, o acordo prevê a utilização, pelo estado de São Paulo, do sistema VigiMed, destinado à notificação de eventos adversos relacionados a medicamentos. O acordo inclui ainda a realização de treinamentos da equipe da Vigilância Sanitária e de notificadores de São Paulo, além da elaboração de materiais educativos e da revisão do marco normativo estadual. Vale observar que o sistema estadual, o Periweb, será desativado.
Avanços
A medida contribuirá para o desenvolvimento do Sistema Nacional de Farmacovigilância (SNFV), no âmbito do Sistema Nacional de Vigilância Sanitária (SNVS). Além disso, deverá fortalecer a farmacovigilância no próprio estado, uma vez que imprime mais robustez à rede de dados para detecção de sinais de segurança de medicamentos.
É importante lembrar que São Paulo conta com o maior parque nacional de indústrias farmacêuticas e a maior concentração de serviços de saúde, inclusive os de alta complexidade. Ademais, o estado detém a maior população dentre as unidades federativas e abriga uma rede de universidades e centros de pesquisa de ponta, ou seja, ele reúne um conjunto de condições favoráveis à farmacovigilância, à identificação de eventos adversos e à geração de conhecimento.
VigiMed: saiba mais
O VigiMed é o sistema nacional para notificação de eventos adversos a medicamentos no Brasil. Ele é mantido pelo Uppsala Monitoring Centre (UMC), um centro colaborador da Organização Mundial da Saúde (OMS) na área de monitoramento global de medicamentos. O sistema utiliza dicionários padronizados para eventos adversos (MedDra) e medicamentos (WhoDrug), o que facilita a organização e a comparação de dados. Categoria
Saúde e Vigilância Sanitária
Tags: farmacovigilância vigimed acordo de cooperação técnica eventos adversos medicamentos
Fonte: Site da ANVISA
Read More
Marco regulatório de rotulagem de medicamentos é aprimorado
A Diretoria Colegiada (Dicol) da Anvisa aprovou, na sua 11ª Reunião Ordinária Pública, um conjunto de alterações pontuais na Resolução da Diretoria Colegiada (RDC) 768, de 12 de dezembro de 2022, que estabelece as regras para a rotulagem de medicamentos, com o intuito de aprimorar o marco regulatório existente.
As alterações preservam o objetivo desse marco regulatório para a segurança do paciente e o uso correto dos medicamentos, garantindo o acesso às informações das embalagens de forma clara e inequívoca.
Nesse sentido, para algumas informações necessárias ao autocuidado do paciente, quando da aquisição e uso de um medicamento isento de prescrição, como por exemplo a indicação e a classe terapêutica de um produto, a alteração aprovada passou a permitir sua colocação na face frontal da embalagem, facilitando assim a sua visualização.
Com objetivo semelhante, foi permitida a colocação da quantidade total do medicamento na face frontal da embalagem. Isso auxilia o cidadão na comparação de preço dos produtos, sem, no entanto, causar prejuízo para a compreensão das informações relacionadas ao uso seguro do medicamento.
Outro aprimoramento importante foi que o uso da técnica conhecida como Tall Man Lettering (TML) passou a ser obrigatório somente para os medicamentos de uso restrito a estabelecimentos de saúde e para aquelas apresentações que sejam destinadas exclusivamente a esse tipo de ambiente. Medicamentos destinados ou de uso restrito a estabelecimentos de saúde são aqueles utilizados em hospitais, clínicas, ambulatórios, serviços de atenção domiciliar e outros estabelecimentos de assistência à saúde.
A técnica de TML é uma das ferramentas utilizadas para ajudar a minimizar os erros de medicações decorridos da troca acidental entre princípios ativos com fonética e/ou ortografia semelhantes, pois consiste em escrever em negrito e em letras maiúsculas a parte diferente do nome dos medicamentos que apresentam essas semelhanças no som e/ou grafia.
Após nova apreciação do tema, entendeu-se pela necessidade de realização de mais estudos para se verificar a aplicação ampla da TML para os demais tipos de medicamentos em que caberia o uso da técnica. Tal conclusão se baseou em diversas referências bibliográficas pesquisadas.
Para os medicamentos com destinação governamental, ou seja, aqueles embalados para serem vendidos ao Governo Federal, foi autorizado que as frases “VENDA SOB PRESCRIÇÃO” e “VENDA SOB PRESCRIÇÃO COM RETENÇÃO DA RECEITA” sejam substituídas pelas frases “USO SOB PRESCRIÇÃO” e “USO SOB PRESCRIÇÃO E RETENÇÃO DA RECEITA”. Além disso, a utilização dessas frases passa a ser obrigatória somente na embalagem secundária do medicamento, considerando-se que tal alteração não trará prejuízo à disposição dos elementos da rotulagem relacionados ao uso seguro dos medicamentos. Categoria
Saúde e Vigilância Sanitária
Tags: medicamentos rotulagem de medicamentos marco regulatório aprimoramento
Fonte: Site da ANVISA
Read More
Avaliação de Resultado Regulatório: manual da Anvisa explica como fazer
A Avaliação de Resultado Regulatório (ARR) é uma ferramenta fundamental para garantir que as regulamentações sejam realmente eficientes, eficazes e alinhadas com os objetivos estratégicos estabelecidos. Ela leva em conta não apenas o alcance dos objetivos iniciais de uma norma, mas também os impactos adicionais que surgiram no mercado e na sociedade como resultado da sua implementação.
À primeira vista, pode-se pensar que essa é uma atividade complexa, mas atuando de forma proporcional é possível planejar uma ARR de forma simples, com as informações desejadas.
Nesse contexto, a Anvisa elaborou o Manual de Avaliação de Resultado Regulatório, com o objetivo de fortalecer a capacidade das suas unidades organizacionais na condução das avaliações do resultado regulatório. Com uma linguagem simples, o manual detalha as etapas que compõem uma ARR, assim como apresenta os principais métodos e ferramentas envolvidos em cada uma delas.
Seguem abaixo alguns dos tópicos abordados no Manual de ARR:
- Fazer ARR não precisa ser complexo
- As etapas para a realização da ARR
- Abordagens de ARR
- Insumos para a ARR
- A importância de planejar a ARR
- Definição de indicadores
- Obtenção, análise e avaliação dos dados
- Métodos de avaliação
- Relatório de ARR e divulgação dos seus resultados
Apesar de o documento ter sido desenvolvido para o uso interno da Anvisa, entendeu-se que a sua publicação poderia contribuir com as ações de melhoria da qualidade regulatória no âmbito da Administração Pública Federal como um todo. Portanto, este material pretende auxiliar entidades governamentais, órgãos reguladores e profissionais envolvidos na formulação de instrumentos regulatórios a conduzirem avaliações sólidas e eficazes referentes aos impactos dessas normas.
Clique aqui e confira o Manual de ARR na íntegra.
Legislação
Página relacionada
Categoria
Saúde e Vigilância Sanitária
Tags: avaliação de resultado regulatório ARR manual de ARR
Fonte: Site da ANVISA
Read More
Agenda Regulatória 2024-2025: lista preliminar de temas está aberta a contribuições
De 31 de julho a 14 de setembro, a sociedade e os entes do Sistema Nacional de Vigilância Sanitária (SNVS) poderão opinar na consulta dirigida sobre a lista preliminar de temas propostos pela Anvisa para priorização na AR 2024-2025. Também é possível sugerir a inclusão de outros temas, caso alguma demanda regulatória de interesse não esteja presente na lista.
As contribuições poderão ser enviadas por meio de formulário eletrônico, aberto à participação de qualquer interessado.
Para que essa participação seja efetiva, as contribuições devem ser claras e bem motivadas pelos interessados (veja a Instrução para Participação), trazendo informações que possibilitem a análise pelas unidades técnicas da Agência responsáveis pela priorização e seleção dos temas, conforme estabelecido no Manual da AR.
Na quinta-feira (3/8), às 15h, será realizado um webinar para apresentação à sociedade dos principais elementos da AR 2024-2025 e orientações para o envio de contribuições à consulta dirigida. Para participar do webinar, não é necessário cadastro prévio: basta acessar este link, no dia e horário marcados.
Entenda
A Agenda Regulatória (AR) é um instrumento de planejamento que tem a finalidade de conferir previsibilidade e dar transparência à atividade regulatória normativa. Ao divulgar antecipadamente os temas regulatórios priorizados para atuação, a Agenda permite que as partes interessadas se preparem para discutir e se adaptar a possíveis mudanças, contribuindo para a construção de um ambiente regulatório estável.
A construção participativa da AR é uma diretriz de destaque na Anvisa, sendo um reflexo do valor contributivo da sociedade para o alinhamento da atuação regulatória da Agência em sua missão de proteger e promover a saúde da população.
Leia também:
Anvisa aprova Manual da Agenda Regulatória
Agenda Regulatória 2024-2025: Anvisa promove webinar sobre consulta dirigida Categoria
Saúde e Vigilância Sanitária
Tags: regulação agenda regulatória AR lista preliminar de temas consulta dirigida participação social
Fonte: Site da ANVISA
Read More
Anvisa publica 3ª edição do documento de perguntas e respostas sobre rotulagem nutricional
A Anvisa publicou, nesta segunda-feira (31/7), a 3ª edição do Documento de Perguntas e Respostas sobre Rotulagem Nutricional de Alimentos.
Essa edição traz a revisão de algumas orientações sobre açúcares adicionados, após a avaliação de dúvidas e solicitações recebidas pela Gerência-Geral de Alimentos (GGALI) sobre o tema e das tratativas do Diálogo Setorial Virtual sobre Açúcares Adicionados, realizado no último dia 3 de julho.
Assim, foram realizadas alterações nas orientações das perguntas 49, 52, 53, 55, 56, 58, 66 e 67. Além disso, foi incluída uma nova pergunta com orientações sobre como definir se as frações de açúcares presentes em aditivos alimentares devem ser consideradas como açúcares adicionados.
Essa atualização tem como objetivo apoiar a adequada implementação da declaração nutricional de açúcares adicionados. Categoria
Saúde e Vigilância Sanitária
Tags: alimentos rotulagem nutricional perguntas e respostas
Fonte: Site da ANVISA
Read More
Participe da Consulta Dirigida sobre o Parecer Público de Avaliação de Medicamentos (PPAM)
A Anvisa quer conhecer quem utiliza, de que forma e colher informações e subsídios para aprimorar o Parecer Público de Avaliação de Medicamentos (PPAM). Com esse objetivo, a Agência abriu, nesta quarta-feira (15/2), uma consulta dirigida sobre o assunto.
O Parecer Público de Avaliação de Medicamentos (PPAM) é um instrumento importante de transparência. É a forma como a Anvisa torna pública a avaliação da segurança, eficácia e qualidade, processo que subsidia a tomada de decisão relativa ao registro de medicamentos, conforme as boas práticas regulatórias e as boas práticas de avaliação da Organização Mundial da Saúde.
Dessa forma, são publicadas as avaliações que resultam em decisões tanto positivas quanto negativas. Em caso de decisão positiva, a solicitação de registro é deferida, ou seja, a princípio, o medicamento é registrado no Brasil. Caso a decisão seja negativa, o pedido de registro é indeferido e o medicamento não poderá ser comercializado no Brasil.Os pareceres públicos disponíveis podem ser consultadosaqui.
Como participar da consulta dirigida?
Para participar, basta responder as perguntas deste questionário. O formulário estará disponível até o dia 17 de março de 2023.
Quem pode participar e como serão utilizadas as informações obtidas?
Qualquer pessoa física, ou representante de organizações da sociedade civil, empresa ou entidade pode participar. Você pode participar de forma anônima ou deixando um e-mail de contato para receber o relatório da consulta. Não serão coletadas informações de caráter pessoal ou confidencial e a participação é voluntária. As respostas ao formulário serão consolidadas e poderão ser publicizadas, a critério da Agência.
Como obter mais informações sobre medicamentos?
Na página de Consulta da Anvisa além do PPAM, que possui informações técnicas destinadas sobre a avaliação que subsidiou a decisão de registro, também é possível consultar informações sobre medicamentos (tais como o status de registro, as bulas dos medicamentos, que contém informações voltadas para o paciente e profissionais de saúde, entre outras informações) e outros produtos regulados pela Anvisa. As empresas podem também consultar o andamento das solicitações de registro, acompanhar o status das avaliações das petições, além de outras informações.
Dúvidas sobre a consulta? Envie uma mensagem para medicamento.novo@anvisa.gov.br
Fonte: Site da ANVISA
Read More
Anvisa recebe contribuições para proposta do Guia ICH M11
Está aberta a consulta pública para contribuições à proposta do Guia ICH M11, que visa definir um modelo de protocolo clínico estruturado, harmonizado e eletrônico para a condução de ensaios clínicos nos países membros do ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use). Uma vez adotado, esse modelo de protocolo clínico deverá ser utilizado pelos patrocinadores que submeterem à Anvisa petições para anuência de ensaios clínicos.
A proposta do ICH M11 em consulta pública é composta por três documentos integrados: as diretrizes (guideline), o modelo de protocolo (template) e a especificação técnica, que estabelece critérios para facilitar a troca eletrônica de informações. Por serem integrados, qualquer alteração em um deles reflete mudança nos demais.
As contribuições deverão ser enviadas preferencialmente em inglês, que é a língua oficial do ICH, até o dia 6 de março, por meio de formulários eletrônicos específicos:
Modelo de protocolo (template) M11
As contribuições recebidas serão compartilhadas com o ICH para avaliação e manifestação. Uma vez adotado o guia pelo ICH, a expectativa é de que a Anvisa o implemente em um ano, com versão traduzida para o português.
Os interessados em conhecer mais detalhes sobre a proposta podem participar do webinar organizado por integrantes do grupo de trabalho do ICH M11, que será realizado na próxima quinta-feira (26/1). O evento é promovido pela Clinical Trials Transformation Initiative (CTTI), uma parceria público-privada fundada pela agência reguladora norte-americana Food and Drug Administration (FDA) e a Duke University. A inscrição gratuita deve ser feita por meio de link específico.
A proposta do Guia ICH M11 na íntegra está publicada no portal do ICH.
Saiba mais
Atualmente, não existe um modelo de protocolo clínico com estrutura e conteúdo internacionalmente harmonizados. A iniciativa do grupo de trabalho M11 do ICH, do qual a Anvisa é membro, tem como objetivo estabelecer esse modelo (template) para promover consistência e harmonização entre patrocinadores no tocante ao formato dos protocolos clínicos a serem apresentados às autoridades. Ademais, busca-se facilitar a troca de informações sobre esses protocolos entre os envolvidos e interessados nos ensaios clínicos dos diferentes países membros do ICH. Adicionalmente, a adoção de um modelo de protocolo clínico harmonizado vai contribuir para a diminuição de eventuais inconsistências e/ou divergências na análise regulatória, agilizando o processo. Categoria
Saúde e Vigilância Sanitária
Fonte: Site da ANVISA
Read More
Anvisa atualiza perguntas e respostas sobre rotulagem nutricional de alimentos
A Anvisa publicou, nesta quinta-feira (19/1), a 2ª edição do Documento de Perguntas e Respostas sobre Rotulagem Nutricional de Alimentos.
Para a elaboração desta edição, foram consideradas as dúvidas trazidas pelos agentes impactados pela medida, recebidas por meio da Central de Atendimento da Anvisa e de documentos protocolados na Agência.
O documento faz uma revisão geral das orientações apresentadas em sua 1ª edição, com o objetivo de melhorar sua clareza e adequar as orientações às modificações realizadas no marco sanitário de alimentos. Também foi levado em consideração na revisão o início da vigência da RDC 429/2020 e da IN 75/2020, em outubro de 2022.
Saiba mais – agenda de alimentos
A regularização de alimentos está relacionada ao controle dos alimentos e embalagens, incluindo os insumos usados na sua produção, como aditivos alimentares, materiais que entram em contato com alimentos e os novos ingredientes.
Em relação aos processos regulatórios de alimentos, a Anvisa concluiu em 2022 a publicação de 29 atos normativos e revogação de 77 atos, como parte das ações de revogação, revisão e consolidação conduzidas no âmbito do Decreto nº 10.139/2019; a publicação de 4 regulamentos para atualização periódica das listas de aditivos alimentares e coadjuvantes de tecnologia, de limites máximos tolerados de contaminantes em alimentos, limites máximos de resíduos de medicamentos veterinários em alimentos de origem animal e de espécies vegetais autorizadas para o preparo de chás e para o uso como especiarias.
No que se refere a Rotulagem Nutricional, as novas normas foram publicadas em outubro de 2020 após uma ampla discussão e participação social e entraram em vigência a partir de outubro de 2022. Com a finalidade de auxiliar no processo de implementação das mudanças aprovadas, uma campanha de comunicação está sendo veiculada no portal da Anvisa e suas redes sociais. Tem sido prestado constantes esclarecimentos aos representantes do setor produtivo para favorecer a adequação dos produtos, seja por meio de respostas ao Serviço de Atendimento da Anvisa (SAT), pela realização de webinares e divulgação de documentos de perguntas e respostas sobre os novos requisitos. Como já programado como parte do processo regulatório, está previsto executar o Monitoramento e Análise do Resultado Regulatório (M&ARR) dos atos normativos de rotulagem nutricional com ampla participação, incluindo o Ministério da Saúde.
O maior desafio no setor de alimentos é acompanhar as inúmeras demandas impostas pelo consumidor cada vez mais atento a alimentação, os avanços tecnológicos dos produtores de alimentos, assim como os compromissos com organismos internacionais dos quais a Anvisa faz parte com o diminuto quadro de servidores da Agência, ainda assim, a Anvisa é pautada pela Agenda Regulatória e justifica todos os seus processos regulatórios publicamente, conforme as diretrizes das Boas Práticas Regulatórias.
Categoria: Saúde e Vigilância Sanitária
Fonte: Site da ANVISA
Read More
RSI: Anvisa lança atividades do monitoramento referente a 2022
A Anvisa lançou, na última quinta-feira (12/1), as atividades de monitoramento das capacidades básicas de vigilância e resposta em saúde pública em pontos de entrada (PoE) designados para o Regulamento Sanitário Internacional (RSI). O lançamento ocorreu durante um webinar destinado ao aprimoramento das atividades de monitoramento realizadas em 16 aeroportos, 17 portos e um ponto de fronteira.
O objetivo do webinar foi prestar informações e orientações aos participantes sobre a realização de atividades locais para avaliar a situação das capacidades do ano de 2022. Portanto, o público da atividade foram profissionais responsáveis e envolvidos em planos de contingência e nas operações relacionadas às capacidades básicas de rotina dos pontos de entrada de portos, aeroportos e áreas de fronteira.
Essas capacidades incluem, por exemplo, a manutenção de planos de contingência para situações de emergência, controles sanitários de entrada e saída de passageiros, inspeções, garantia de acesso a serviços de saúde, entre outras medidas. O monitoramento dessas atividades visa obter informações que contribuam para a análise e a melhoria do trabalho realizado, permitindo o adequado controle sanitário nos pontos de entrada.
Vale ressaltar que o trabalho de monitoramento já teve início e deverá ser finalizado até o dia 25/1/2023. A tarefa envolve autoridades sanitárias locais, como a vigilância em saúde, órgãos como a Polícia Federal, além de administradores e operadores dos pontos de entrada, entre outros. Após receber as informações levantadas localmente, a Anvisa irá consolidar os dados e enviá-los para a Organização Mundial da Saúde (OMS).
Aspectos abordados
Durante o webinar, foi feita uma contextualização geral sobre o RSI, desde a aprovação da sua primeira versão pela Organização Mundial de Saúde (OMS), em 1951, até a aprovação da atualização do documento, em 2005, que ampliou as atividades para o fortalecimento das capacidades de vigilância e resposta, além da atuação diante de situação de Emergência de Saúde Pública de Importância Internacional (ESPII).
Também foram apresentadas as capacidades básicas de vigilância e resposta em saúde pública previstas no anexo 1B da Lei 10.212/2020, que promulgou o RSI revisado. O webinar abordou também a implementação de atividades e aspectos relacionados à ferramenta de autoavaliação e ao relatório anual dos dados obtidos. O instrumento de avaliação a ser aplicado no monitoramento abrange informações gerais dos pontos de entrada e capacidades essenciais, bem como medidas relacionadas a viagens internacionais, entre outras questões.
A atividade de monitoramento discutida no webinar é parte do projeto estratégico da Anvisa para o “Aprimoramento das capacidades básicas de vigilância em pontos de entrada pós pandemia da covid-19“, de forma a tornar o país mais preparado para futuras pandemias.
Acesse também:
- Apresentação sobre o aprimoramento das capacidades básicas de vigilância em Pontos de Entrada.
- Instrumento de monitoramento das capacidades básicas de vigilância em Pontos de Entrada.
Categoria
Saúde e Vigilância Sanitária
Fonte: Site da ANVISA
Read More
