
Regulação de alimentos: consolidação de atos normativos
Em continuidade ao processo de revisão e consolidação de atos normativos, foram publicadas, no Diário Oficial da União (D.O.U.) desta quarta-feira (6/7), 18 Resoluções da Diretoria Colegiada (RDC) e quatro Instruções Normativas (IN) relacionadas à regulação de alimentos. Esses 22 atos substituem 51 regulamentos que foram revogados. Os novos atos entrarão em vigor no dia 1º de setembro, exceto a RDC 729/2022, cuja vigência terá início em 9 de outubro.
Todas as alterações realizadas têm como objetivo aprimorar a redação e a forma dos atos normativos, de modo a imprimir mais clareza, sem alterar o mérito dos conteúdos. Ou seja, não foi realizada nenhuma alteração dos requisitos atualmente aplicados aos produtos abrangidos pelos regulamentos.
Resoluções publicadas: entenda
RDC 711/2022: Dispõe sobre os requisitos sanitários dos amidos, biscoitos, cereais integrais, cereais processados, farelos, farinhas, farinhas integrais, massas alimentícias e pães. Resultado da revisão da RDC 236/2005.
RDC 712/2022: Dispõe sobre os requisitos de composição e rotulagem dos alimentos contendo cereais e pseudocereais para classificação e identificação como integral e para destaque da presença de ingredientes integrais. Resultado da revisão da RDC 493/2021.
RDC 713/2022: Dispõe sobre os requisitos sanitários dos gelados comestíveis e dos preparados para gelados comestíveis. Resultado da revisão da RDC 266/2005.
RDC 714/2022: Dispõe sobre os requisitos sanitários para enriquecimento e restauração de alimentos. Resultado da revisão da Portaria SVS/MS 31/1998.
RDC 715/2022: Dispõe sobre os requisitos sanitários do sal hipossódico, dos alimentos para controle de peso, dos alimentos para dietas com restrição de nutrientes e dos alimentos para dietas de ingestão controlada de açúcares. Resultado da revisão e consolidação das Portarias SVS/MS 54/1995; SVS/MS 29/1998; SVS/MS 30/1998 e das RCDs 135/2017 e 155/2017.
RDC 716/2022: Dispõe sobre os requisitos sanitários do café, cevada, chás, erva-mate, especiarias, temperos e molhos e IN 159/2022, que estabelece as listas das partes de espécies vegetais autorizadas para o preparo de chás e para o uso como especiarias, resultantes da revisão e consolidação das RDCs 267/2005; 276/2005; 277/2005, 219/2006 e arts. 2º e 3º e Anexos I e II da RDC 450/2020.
RDC 717/2022: Dispõe sobre os requisitos sanitários das águas envasadas e do gelo para consumo humano. Resultado da revisão e consolidação das RDCs 274/2005 e 316/2019.
RDC 719/2022: Dispõe sobre os requisitos sanitários das misturas para o preparo de alimentos e dos alimentos prontos para o consumo. Resultado da revisão da RDC 273/2005.
RDC 720/2022: Dispõe sobre os requisitos sanitários dos alimentos nutricionalmente modificados. Resultado da revisão RDC 3/2013.
RDC 722/2022: Dispõe sobre os limites máximos tolerados (LMT) de contaminantes em alimentos, os princípios gerais para o seu estabelecimento e os métodos de análise para fins de avaliação de conformidade, como resultado da revisão da RDC 487/2021 e IN 160/2022, que estabelece os limites máximos tolerados (LMT) de contaminantes em alimentos, como resultado da revisão e consolidação das INs 88/2021, 115/2021 e 152/2022.
RDC 723/2022: Dispõe sobre os requisitos sanitários do açúcar, açúcar líquido invertido, açúcar de confeitaria, adoçante de mesa, bala, bombom, cacau em pó, cacau solúvel, chocolate, chocolate branco, goma de mascar, manteiga de cacau, massa de cacau, melaço, melado e rapadura. Resultado da revisão e consolidação da Resolução CNNPA 3/1976 e das RDCs 264/2005; 265/2005; 271/2005 e 450/2020.
RDC 724/2022: Dispõe sobre os padrões microbiológicos dos alimentos e sua aplicação, como resultado da revisão da RDC 331/2019 e IN 161/2022, que estabelece os padrões microbiológicos dos alimentos, resultante da revisão e consolidação das INs 60/2019; 79/2020 e 110/2021.
RDC 725/2022: Dispõe sobre os aditivos alimentares aromatizantes. Resultado da revisão e consolidação da RDC 2/2007 e da IN 15/2017.
RDC 726/2022: Dispõe sobre os requisitos sanitários dos cogumelos comestíveis, dos produtos de frutas e dos produtos de vegetais. Resultado da revisão e consolidação das RDCs 17/1999; 91/2000; 268/2005; 272/2005 e 85/2016.
RDC 727/2022: Dispõe sobre a rotulagem dos alimentos embalados. Resultado da revisão e consolidação das RDCs 259/2002; 123/2004; 340/2002; 35/2009; 26/2015; 136/2017; 459/2020 e IN 67/2020.
RDC 728/2022: Dispõe sobre as enzimas e as preparações enzimáticas para uso como coadjuvantes de tecnologia na produção de alimentos destinados ao consumo humano. Resultado da revisão e consolidação das RDCs 53/2014 e 54/2014.
RDC 730/2022: Dispõe sobre a avaliação do risco à saúde humana de medicamentos veterinários, os limites máximos de resíduos (LMR) de medicamentos veterinários em alimentos de origem animal e os métodos de análise para fins de avaliação da conformidade, como resultado da revisão da RDC 328/2019 e IN 162/2022, que estabelece a ingestão diária aceitável (IDA), a dose de referência aguda (DRfA) e os limites máximos de resíduos (LMR) para insumos farmacêuticos ativos (IFA) de medicamentos veterinários em alimentos de origem animal, resultante da revisão e consolidação das INs 51/2019; 89/2021 e 117/2022.
Foi publicada também a RDC 729/2022, que dispõe sobre a melhoria da técnica legislativa e revogação de normas inferiores a decreto editadas pela Anvisa, componentes da quinta etapa de consolidação da pertinência temática de alimentos, em observância ao que prevê a Portaria 488/GADIP-DP/Anvisa, de 23 de setembro de 2021, e o Decreto 10.139/2019. Vale lembrar que as alterações pontuais promovidas pela RDC 729/2022 não modificam o mérito das normas afetadas, visando apenas manter a consistência normativa com outras alterações que foram realizadas como parte do processo de revisão e consolidação.
A RDC 729/2022 entrará em vigor em 9 de outubro de 2022, porque incorpora alterações sobre a rotulagem nutricional de alimentos embalados, alterações essas que entrarão em vigor na respectiva data.
Em caso de dúvidas ou para saber mais, acesse Avaliação e consolidação de normas.
Fonte: Site da ANVISA
Read More
Petições de IFA e Cadifa serão migradas para o Sistema Solicita
A Anvisa informa que as petições relacionadas ao registro de Insumo Farmacêutico Ativo (IFA) e à Carta de Adequação de Dossiê de Insumo Farmacêutico Ativo (Cadifa) passarão a ser recebidas por meio do Sistema Solicita. A migração ocorrerá conforme orientação abaixo:
- A partir do dia 30/6/2022, para recebimento das petições relacionadas ao registro de Insumo Farmacêutico Ativo (IFA), instituído pela Resolução da Diretoria Colegiada (RDC) 57/2009.
- A partir de 30/8/2022, para recebimento das petições relacionadas à Carta de Adequação de Dossiê de Insumo Farmacêutico Ativo (Cadifa), instituída pela Resolução da Diretoria Colegiada (RDC) 359/2020.
A medida faz parte da transformação digital da Anvisa e objetiva padronizar os procedimentos, possibilitando o acompanhamento das petições protocoladas na Agência. Com a migração, não haverá mais peticionamento de assuntos relacionados ao registro de IFA e de Cadifa por protocolo manual, nem pelo sistema de peticionamento.
Nesse sentido, será por meio do Sistema Solicita que as empresas farão o peticionamento, acompanhamento das mensagens, cumprimento de exigências e recurso. Esse sistema permite que se faça o carregamento de vários arquivos de até 25MB de forma simultânea. Ele permite ainda anexar arquivos dos tipos jpg, jpeg, bmp, png, pdf, doc, docx, xls e xlsx.
É importante esclarecer que, após a submissão de um arquivo, o usuário poderá visualizar esse arquivo dentro do próprio sistema. Confira o webinar “Sistema Solicita – esclareça suas dúvidas e conheça as novidades”.
A Agência recomenda ainda consultar o Manual do Usuário e o documento Perguntas e Respostas sobre o tema.
Confira abaixo os assuntos que estarão disponíveis no Solicita a partir de 30/6/2022:
| 10309 | Insumos Farmacêuticos Ativos – Alteração de Embalagem Externa |
| 10310 | Insumos Farmacêuticos Ativos – Alteração de perfil granulométrico |
| 10311 | Insumos Farmacêuticos Ativos – Alteração de prazo de validade |
| 10312 | Insumos Farmacêuticos Ativos – Alteração do teor de solvente residual |
| 10325 | Insumos Farmacêuticos Ativos – Atualização de Especificações e Métodos Analíticos |
| 10316 | Insumos Farmacêuticos Ativos – Inclusão de local de etapa de fabricação |
| 10330 | Insumos Farmacêuticos Ativos – Mudança de local de fabricação |
| 10921 | Insumos Farmacêuticos Ativos – Outras alterações pós-registro |
| 10731 | Registro de IFA – Aditamento DMF parte fechada |
Confira abaixo os assuntos que estarão disponíveis no Solicita a partir de 30/8/2022:
| 11712 | CADIFA – Aditamento | Additional Information |
| 11715 | CADIFA – Cancelamento | Withdrawal (ANVISA) |
| 11716 | CADIFA – Cancelamento | Withdrawal (Holder) |
| 11719 | CADIFA – Comunicado de resultado fora da especificação em estudo de estabilidade | Communication of out of specification results in stability study |
| 11717 | CADIFA – Desistência | Closure |
| 11638 | CADIFA – Manifestação de Interesse | Expression of Interest |
| 11640 | CADIFA – Mudança | Change 1.1 |
| 11641 | CADIFA – Mudança | Change 1.2 |
| 11642 | CADIFA – Mudança | Change 1.3 |
| 11643 | CADIFA – Mudança | Change 1.4 |
| 11644 | CADIFA – Mudança | Change 1.5 |
| 11645 | CADIFA – Mudança | Change 1.6 |
| 11646 | CADIFA – Mudança | Change 1.7 |
| 11696 | CADIFA – Mudança | Change 2.10 |
| 11647 | CADIFA – Mudança | Change 2.1.1 |
| 11697 | CADIFA – Mudança | Change 2.11.1 |
| 11698 | CADIFA – Mudança | Change 2.11.2 |
| 11648 | CADIFA – Mudança | Change 2.1.2 |
| 11699 | CADIFA – Mudança | Change 2.12.1 |
| 11700 | CADIFA – Mudança | Change 2.12.2 |
| 11701 | CADIFA – Mudança | Change 2.12.3 |
| 11702 | CADIFA – Mudança | Change 2.12.4 |
| 11649 | CADIFA – Mudança | Change 2.1.3 |
| 11703 | CADIFA – Mudança | Change 2.13.1 |
| 11704 | CADIFA – Mudança | Change 2.13.2 |
| 11650 | CADIFA – Mudança | Change 2.1.4 |
| 11705 | CADIFA – Mudança | Change 2.14 |
| 11706 | CADIFA – Mudança | Change 2.15 |
| 11707 | CADIFA – Mudança | Change 2.16.1 |
| 11708 | CADIFA – Mudança | Change 2.16.2 |
| 11709 | CADIFA – Mudança | Change 2.17.1 |
| 11710 | CADIFA – Mudança | Change 2.17.2 |
| 11651 | CADIFA – Mudança | Change 2.2.1 |
| 11652 | CADIFA – Mudança | Change 2.2.2 |
| 11653 | CADIFA – Mudança | Change 2.2.3 |
| 11659 | CADIFA – Mudança | Change 2.3.1 |
| 11660 | CADIFA – Mudança | Change 2.3.2 |
| 11661 | CADIFA – Mudança | Change 2.3.3 |
| 11662 | CADIFA – Mudança | Change 2.3.4 |
| 11663 | CADIFA – Mudança | Change 2.3.5 |
| 11664 | CADIFA – Mudança | Change 2.4.1 |
| 11665 | CADIFA – Mudança | Change 2.4.2 |
| 11666 | CADIFA – Mudança | Change 2.4.3 |
| 11667 | CADIFA – Mudança | Change 2.4.4 |
| 11668 | CADIFA – Mudança | Change 2.4.5 |
| 11669 | CADIFA – Mudança | Change 2.5.1 |
| 11670 | CADIFA – Mudança | Change 2.5.2 |
| 11671 | CADIFA – Mudança | Change 2.5.3 |
| 11672 | CADIFA – Mudança | Change 2.6.1 |
| 11673 | CADIFA – Mudança | Change 2.6.2 |
| 11674 | CADIFA – Mudança | Change 2.6.3 |
| 11675 | CADIFA – Mudança | Change 2.6.4 |
| 11676 | CADIFA – Mudança | Change 2.6.5 |
| 11677 | CADIFA – Mudança | Change 2.6.6 |
| 11678 | CADIFA – Mudança | Change 2.6.7 |
| 11679 | CADIFA – Mudança | Change 2.6.8 |
| 11680 | CADIFA – Mudança | Change 2.6.9 |
| 11681 | CADIFA – Mudança | Change 2.7.1 |
| 11682 | CADIFA – Mudança | Change 2.7.2 |
| 11683 | CADIFA – Mudança | Change 2.7.3 |
| 11684 | CADIFA – Mudança | Change 2.7.4 |
| 11685 | CADIFA – Mudança | Change 2.7.5 |
| 11686 | CADIFA – Mudança | Change 2.7.6 |
| 11687 | CADIFA – Mudança | Change 2.7.7 |
| 11688 | CADIFA – Mudança | Change 2.7.8 |
| 11689 | CADIFA – Mudança | Change 2.7.9 |
| 11690 | CADIFA – Mudança | Change 2.8.1 |
| 11691 | CADIFA – Mudança | Change 2.8.2 |
| 11692 | CADIFA – Mudança | Change 2.8.3 |
| 11693 | CADIFA – Mudança | Change 2.9.1 |
| 11694 | CADIFA – Mudança | Change 2.9.2 |
| 11695 | CADIFA – Mudança | Change 2.9.3 |
| 11711 | CADIFA – Mudança Menor por Exclusão | Minor Change by Default |
| 11720 | CADIFA – Recurso | Reconsideration |
| 11718 | CADIFA – Retificação | Correction |
| 11637 | CADIFA – Solicitação de CADIFA Associada | Associated CADIFA Application |
| 11639 | CADIFA – Solicitação de CADIFA Não Associada | Standalone CADIFA Application |
| 11713 | CADIFA – Suspensão | Suspension (ANVISA) |
| 11714 | CADIFA – Suspensão | Suspension (Holder) |
Quer saber as notícias da Anvisa em primeira mão? Siga-nos no Twitter @anvisa_oficial, Facebook@AnvisaOficial, Instagram @anvisaoficial e YouTube @anvisaoficial
Categoria
Saúde e Vigilância Sanitária
Tags: peticionamento IFA CADIFA migração Sistema Solicita
Fonte: Site da ANVISA
Read More
Anvisa realiza webinar com entidades da área de medicamentos
A Anvisa irá realizar na próxima quinta-feira (2/6), a partir das 15h, um seminário virtual com as associações de medicamentos sobre diversos tópicos da área de fiscalização. Na ocasião, serão abordados temas como as inspeções remotas e o trabalho da Agência frente às adequações exigidas pelo Esquema de Cooperação em Inspeção Farmacêutica (PIC/S, do inglês Pharmaceutical Inspection Co-operation Scheme).
O encontro irá tratar ainda sobre o processo de harmonização do Conselho Internacional de Harmonização de Requisitos Técnicos para Produtos Farmacêuticos de Uso Humano (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use – ICH), entre outros assuntos. Durante o seminário, os participantes poderão esclarecer dúvidas sobre os temas.
Para participar do webinar, basta clicar no link abaixo, no dia e horário agendados. Não é preciso fazer cadastro prévio.
Dia 2/6, às 15h – Webinar: Videoconferência Anvisa e associações de medicamentos
Webinar
O webinar é um seminário virtual que tem como objetivo fortalecer as iniciativas de transparência da Anvisa, levando conteúdo e conhecimento atualizado ao público. A transmissão é via web e a interação com os usuários é feita em tempo real, por um chat realizado durante o evento. Confira a página específica de Webinares realizados pela Agência.
Quer saber as notícias da Anvisa em primeira mão? Siga-nos no Twitter @anvisa_oficial, Facebook @AnvisaOficial, Instagram @anvisaoficial e YouTube @anvisaoficial
Fonte: Site da ANVISA
Read More
NOMEAÇÃO – DIRETOR DA ANVISA
DECRETOS DE 25 DE ABRIL DE 2022
O PRESIDENTE DA REPÚBLICA, no uso da atribuição que lhe confere o art. 84,caput, inciso XIV, da Constituição, e tendo em vista o disposto no art. 10, parágrafo único, da Lei nº 9.782, de 26 de janeiro de 1999, resolve:
NOMEAR
a partir de 25 de julho de 2022, DANIEL MEIRELLES FERNANDES PEREIRA, para exercer o cargo de Diretor da Agência Nacional de Vigilância Sanitária – ANVISA, com mandato até 24 de julho de 2027, na vaga decorrente do término do mandato de Cristiane Rose Jourdan Gomes.
Brasília, 25 de abril de 2022; 201º da Independência e 134º da República.
JAIR MESSIAS BOLSONARO
Marcelo Antônio Cartaxo Queiroga Lopes
Fonte: Diário Oficial da União de 26/04/2022
Read More
Nota Anvisa: vigência do uso emergencial de vacinas e medicamentos
Anvisa está revisando a vigência dos atos editados pela Agência em resposta à pandemia de Covid-19. Estão incluídos entre os atos as resoluções que tratam do uso emergencial de vacinas e medicamentos.
Diversos atos editados de forma excepcional pela Anvisa, em resposta à Covid-19, previam inicialmente o encerramento de sua vigência a partir do fim do estado de Emergência de Saúde Pública de Importância Nacional.
A solicitação feita pelo Ministério da Saúde é que a vigência das normas da Anvisa para a pandemia seja mantida por um ano a partir do momento da retirada do estado de Emergência de Saúde Pública de Importância Nacional. A prorrogação do prazo de vigência das normas ainda depende de aprovação da Diretoria Colegiada da Anvisa e, se aprovada, deve permitir que vacinas e medicamentos em uso emergencial continuem em uso por um ano.
A Anvisa destaca que a vacinação contra Covid-19 deve continuar em andamento e que a dose de reforço deve ser aplicada nos públicos indicados.
É necessário também que a vigilância epidemiológica sobre a doença continue por meio dos programas de testagem e mapeamento genômico do vírus em circulação no Brasil. A medida é necessária diante da possibilidade de surgimento de novas variantes.
Cada pessoa deve continuar atenta às medidas de higienização das mãos e uso de máscara em ambientes de maior risco, com aglomerações.
Vale ressaltar que, apesar dos avanços alcançados no Brasil, muitos países ainda continuam em estado de pandemia e com índices de vacinação ainda baixos, necessitando imunizar suas populações.
Fonte: Site da ANVISA
Read More
Publicado 1º boletim sobre monitoramento pós-mercado
A Anvisa lançou, nesta segunda-feira (4/4), o 1º Boletim Informativo sobre Monitoramento Pós-Mercado de produtos e serviços sujeitos à vigilância sanitária. A publicação inédita é uma produção da Gerência-Geral de Monitoramento de Produtos Sujeitos à Vigilância Sanitária (GGMON) e traz os principais resultados alcançados no processo de acompanhamento realizado por meio do Sistema de Notificação e Investigação em Vigilância Sanitária (Vigipós), ao longo de 2021.
O monitoramento é realizado com base nos dados do Notivisa, uma plataforma criada para receber notificações de eventos adversos e queixas técnicas, sendo o sistema informatizado responsável por operacionalizar o Vigipós. Também foram utilizadas informações de um outro sistema chamado VigiMed, destinado às notificações de eventos adversos relacionados ao uso de medicamentos e vacinas.
Nesta publicação de estreia, o informativo traz dados gerais do monitoramento nacional de alimentos (nutrivigilância); células, tecidos e órgãos doados e transplantados (biovigilância); cosméticos (cosmetovigilância); e dispositivos médicos (tecnovigilância). Também constam informações relacionadas a medicamentos (farmacovigilância); fármacos submetidos a controle especial (vigilância de controlados); ciclo da doação e transfusão de sangue (hemovigilância); e vigilância de saneantes.
A partir desta primeira edição, o Boletim Informativo sobre Monitoramento Pós-Mercado terá periodicidade trimestral e ficará disponível para consulta no portal da Agência.
Confira a íntegra do 1º Boletim Informativo sobre Monitoramento Pós-Mercado.
Fonte: Site da ANVISA
Read More
Consulta de autorização de funcionamento tem novas funcionalidades
A partir desta segunda-feira (28/3), a consulta de Autorização de Funcionamento de Empresa (AFE) e Autorização especial (AE) terá novas funcionalidades.
Também haverá unificação das consultas de Autorização de Farmácias e Drogarias com as demais empresas. Conheça as principais mudanças.
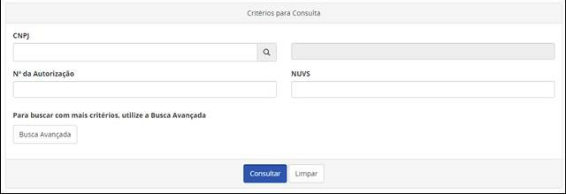
Novidades
Ao clicar em “Busca Avançada”, será possível realizar buscas de empresas por estado, cidade, atividade ou classe da autorização. Na hora de fazer a busca, é importante lembrar que a autorização sempre é concedida no CNPJ da matriz da empresa. As filiais podem exercer as atividades, desde que estejam licenciadas pela Vigilância Sanitária.
Caso a empresa tenha alguma medida cautelar (produto irregular identificado pela Anvisa), essa informação também será exibida. Ao clicar no botão “Medida Cautelar”, o sistema abrirá uma nova aba com o detalhamento da medida.
O mesmo acontece no caso de CBPF (Certificado de Boas Práticas de Fabricação) ou CBPDA (Certificado de Boas Práticas de Distribuição e Armazenagem). Caso a empresa tenha certificados vigentes, as informações também estarão disponíveis.
Uma outra novidade é a possibilidade de exportar para Excel os resultados das buscas, permitindo o tratamento dos dados. A nova consulta também irá disponibilizar o site e o SAC (Serviço de Atendimento ao Consumidor) da empresa. Essas informações poderão ser atualizadas pela empresa direto no Cadastro de Empresas, sem a necessidade de peticionamento ou solicitação junto ao Fale Conosco.

Gases medicinais
Com relação à AFE para gases medicinais, o campo “Área de Produto” irá trazer tanto a opção de medicamentos quanto de gases medicinais.
A numeração de AFE utilizando o filtro de gases medicinais busca apenas as autorizações com iniciais 22. Tendo em vista a o esgotamento da numeração de AFEs iniciadas pelo número 22, algumas autorizações para gases medicinais foram concedidas com a numeração iniciada em 1, disponíveis no filtro de medicamentos.
Fonte: Site da ANVISA
Read More
Sistema de peticionamento de licença de importação apresenta falhas
Devido a falhas no sistema de informação, a Anvisa identificou a ocorrência de petições que, embora protocoladas, não foram disponibilizadas para a área responsável. Diante disso, tais petições podem não ter sido distribuídas para análise, acarretando atraso na anuência.
Sendo assim, a Agência orienta que os importadores de produtos sujeitos à vigilância sanitária com petições protocolizadas com prazo superior a cinco dias úteis e sem manifestação da Anvisa informem os dados de tais processos de importação por meio dos canais de atendimento, para que as petições sejam devidamente analisadas. Tal medida objetiva reduzir possíveis atrasos na anuência de processos de importação.
A Agência agradece a compreensão de todos.
Fonte: Site da ANVISA
Read More
Anvisa adota medidas para garantir a segurança de medicamentos do tipo “sartanas” utilizados no Brasil
A Anvisa vem adotando uma série de medidas após a detecção de impurezas, chamadas de nitrosaminas, nos princípios ativos conhecidos como “sartanas”, como a losartana e a valsartana, utilizados na fabricação de medicamentos para o tratamento de hipertensão arterial (pressão alta).
No ano de 2018, a Anvisa e agências reguladoras em todo o mundo ficaram cientes da presença de nitrosaminas acima dos níveis permitidos em medicamentos da classe das “sartanas”, e adotaram medidas para o controle sanitário desse tipo de impureza.
As nitrosaminas são compostos comumente encontrados na água, em alimentos defumados e grelhados, laticínios e vegetais. Sabe-se que a exposição a esses compostos dentro de limites seguros representa baixo risco de agravos à saúde. No entanto, acima de níveis aceitáveis e por longo período, a exposição às nitrosaminas pode aumentar o risco da ocorrência de câncer.
No Brasil, as ações de controle promovidas pela Anvisa foram iniciadas com inspeções realizadas em 30 empresas fabricantes de medicamentos, nas quais foram inspecionados 111 produtos. Como resultado, 31 ações sanitárias foram efetuadas, incluindo interdições, suspensões e recolhimento de medicamentos.
Em 2019, foi reportada a presença de nitrosaminas em outras classes de medicamentos, como nizatidina, ranitidina e metformina, que por sua vez levou à publicação de suspensões da importação, distribuição, comercialização e uso de determinados produtos.
Em 2020, foi lançado o programa de monitoramento de nitrosaminas, no qual amostras dos medicamentos e dos insumos farmacêuticos ativos losartana e valsartana foram submetidos a análise laboratorial conduzida pelo Instituto Nacional de Controle de Qualidade em Saúde (INCQS), para identificação e quantificação dessas impurezas. Os resultados do programa podem ser observados no painel disponibilizado no portal da Anvisa.
Atualmente, estão em vigor a Resolução da Diretoria Colegiada (RDC) 238/2019, que instituiu a necessidade de o setor produtivo investigar, controlar e eliminar nitrosaminas potencialmente carcinogênicas, e o Guia 50/2021, com recomendações quanto ao controle de nitrosaminas em insumos farmacêuticos ativos (IFAs) e medicamentos.
O recolhimento voluntário é um processo iniciado pela empresa responsável pela regularização do produto junto à Anvisa, em observância ao art. 6º da Lei 6.360, de 23 de setembro de 1976, e à RDC 55/2005. A Anvisa publica no Diário Oficial da União tanto os recolhimentos voluntários, iniciados pelas empresas, quanto os recolhimentos determinados pela própria Agência.
Os recolhimentos, voluntários ou não, se referem sempre a lotes específicos de medicamentos.
Para conferir todas as ações de recolhimento, suspensão e interdição de medicamentos determinadas pela Anvisa, acesse: https://www.gov.br/anvisa/pt-br/assuntos/fiscalizacao-e-monitoramento/consulta-de-produtos-irregulares.
Fonte: Site da ANVISA
Read More
Anvisa e FDA renovam declaração de cooperação técnica
A Anvisa e a Administração de Alimentos e Medicamentos dos Estados Unidos (FDA, do inglês Food and Drug Administration) assinaram uma Declaração de Cooperação visando manter e fortalecer os seus mecanismos de colaboração. Nesta terça-feira (8/3), os signatários representantes das duas agências reuniram-se virtualmente para celebrar a assinatura do documento.
O documento, que substitui declaração anterior, foi negociado entre as duas autoridades para dar continuidade à cooperação já consolidada na área de regulação sanitária, mantendo o intercâmbio de informações técnicas e explorando novas oportunidades de parcerias.
Ao longo da pandemia de Covid-19, as duas agências têm colaborado ativamente na análise de produtos e têm estabelecido uma comunicação contínua.
A Anvisa e a FDA participam dos principais fóruns internacionais relacionados a produtos sujeitos à vigilância sanitária. Ambas as agências são autoridades reguladoras nacionais de referência no âmbito da Organização Pan-Americana da Saúde (Opas), vinculada à Organização Mundial da Saúde (OMS).
Além disso, desde 2020 a Anvisa participa do Projeto Orbis, coordenado pela FDA com a finalidade de agilizar o registro e o acesso a medicamentos oncológicos, por meio de análises conjuntas.
Clique aqui e saiba mais sobre a cooperação internacional da Agência.
Fonte: Site da ANVISA
Read More
