
Medicamentos: novo fluxo para petições de aditamento
A Anvisa informa que, a partir do próximo dia 1º de novembro, será implantado um novo fluxo para petições de aditamento de processos de registro e pós-registro de medicamentos, insumos farmacêuticos ativos (IFAs) e de pesquisa clínica. A partir de então, essas petições deverão ser protocolizadas por meio do peticionamento eletrônico, via Sistema Solicita, utilizando os códigos de assunto listados ao final.
Resultado do aprimoramento do trabalho desenvolvido pela área de Medicamentos da Agência, o objetivo da medida é dar mais agilidade a essas demandas, bem como padronizar os procedimentos.
Com o envio exclusivamente eletrônico dessas petições, o expediente será imediatamente aditado ao processo, acelerando sua análise, principalmente nos casos em que a petição à qual se refere já estiver em análise. Ressalta-se que os aditamentos não serão considerados quando a análise da petição a que se refere já estiver finalizada (análise concluída).
É importante ressaltar ainda que estes assuntos podem ser vinculados a petições primárias ou secundárias e que a correta vinculação é feita pela empresa durante o peticionamento. Dessa forma, vincular o aditamento ao expediente correto é de suma importância para a localização da complementação enviada.
De acordo com a RDC 204/2005, os aditamentos devem ser utilizados para toda e qualquer complementação ao processo, não exigida formalmente, que se limita ao aprimoramento do conhecimento do objeto do processo, não resultando em manifestação diversa da peticionada. Dessa forma, destaca-se que um aditamento nunca deverá ser utilizado como petição de pós-registro; caso contrário, isso poderá prejudicar a empresa, por exemplo, em uma análise fiscal do produto.
Confira abaixo quais são os códigos de assuntos que deverão ser peticionados nesse novo fluxo:
| 10118 | CENTRO DE EQUIVALÊNCIA FARMACÊUTICA – Aditamento |
| 11516 | CERTIFICAÇÃO DE BOAS PRÁTICAS DE BIODISPONIBILIDADE/BIOEQUIVALÊNCIA – MEDICAMENTOS – Aditamento |
| 1620 | DINAMIZADO – Aditamento |
| 1363 | ENSAIOS CLÍNICOS – Aditamento |
| 1741 | ESPECÍFICO – Aditamento |
| 1952 | GENÉRICO – Aditamento |
| 1719 | MEDICAMENTO FITOTERÁPICO – Aditamento |
| 1432 | MEDICAMENTO NOVO – Aditamento |
| 1913 | PRODUTO BIOLÓGICO – Aditamento |
| 11554 | PRODUTO DE CANNABIS – Aditamento |
| 10635 | PRODUTO TRADICIONAL FITOTERÁPICO – Aditamento |
| 10366 | RADIOFÁRMACO – Aditamento |
| 10322 | Registro de IFA – Aditamento (Petições de Registro, Pós-Registro e Renovação) |
| 1416 | SIMILAR – Aditamento |
Fonte: Site da ANVISA
Read More
GGTIN seleciona consultores técnicos especializados por meio de projeto de cooperação entre Anvisa e PNUD
Mediante um Projeto de Cooperação Técnica Internacional entre a Anvisa e o Programa das Nações Unidas para o Desenvolvimento (PNUD), serão contratados dois consultores, por tempo limitado, com o objetivo de avaliar a atuação da Gerência Geral de Tecnologia da Informação (GGTIN) da Agência, de forma a melhorar a qualidade e a produtividade dos serviços prestados.
Termo de Referência 01
Termo de Referência 02
Se o seu perfil profissional for adequado a um destes editais, favor enviar seu currículo conforme modelo padrão e orientações constantes nos Termos de Referência para o e-mail ugp@anvisa.gov.br. No campo assunto, deve ser observado o “item 10” do(s) edital/editais de interesse.
O período para recebimento dos currículos será de 18 a 22/10/2021.
Fonte: Site da ANVISA
Read More
Anvisa autoriza melatonina na forma de suplemento alimentar
A Diretoria Colegiada (Dicol) da Anvisa aprovou por unanimidade, nesta quinta-feira (14/10), o uso da substância melatonina para a formulação de suplementos alimentares, destinados exclusivamente a pessoas com idade igual ou maior que 19 anos e para o consumo diário máximo de 0,21 mg.
Os suplementos de melatonina deverão conter advertência de que o produto não deve ser consumido por gestantes, lactantes, crianças e pessoas envolvidas em atividades que requerem atenção constante.
Pessoas com enfermidades ou que usem outros medicamentos deverão consultar seu médico antes de consumir a substância.
Não foram aprovadas alegações de benefícios associadas ao consumo de suplementos alimentares à base de melatonina.
A aprovação da Diretoria Colegiada ocorreu por meio da alteração da Instrução Normativa (IN) 28/2018, que aprova a lista de constituintes autorizados para uso em suplementos alimentares.
Também foram autorizados outros 40 novos constituintes de suplementos alimentares, incluindo: membrana de casca de ovo como fonte de ácido hialurônico, glicosaminoglicanos e colágeno, extrato de laranja moro (Citrus sinensis (L.) Osbeck) como fonte de antocianinas, extrato de rizomas de cúrcuma como fonte de curcumina, um microrganismo isolado que pode auxiliar na resposta imune de idosos à vacina contra influenza e uma enzima protease que pode auxiliar na digestão do glúten.
Os constituintes autorizados para o uso em suplementos alimentares podem ser consultados no portal da Anvisa.
O que é melatonina?
É um hormônio produzido naturalmente no cérebro humano, que auxilia no ciclo vigília-sono (também chamado de “relógio biológico”). Essa substância pode ser encontrada em pequenas concentrações nos alimentos, incluindo morango, cereja, uva, banana, abacaxi, laranja, mamão papaia, manga, tomate, azeitona, cereais, vinhos, carne (frango, carneiro, porco), leite de vaca e outros produtos alimentícios. A melatonina também pode ser produzida sinteticamente.
A partir da decisão da Anvisa, a melatonina poderá estar disponível, sem receita, como um suplemento alimentar, uma categoria de produtos destinada à complementação da dieta de pessoas saudáveis com substâncias presentes nos alimentos, incluindo nutrientes e substâncias bioativas, onde se enquadra a melatonina.
A substância em questão já é utilizada em diversos países como suplemento alimentar e como medicamento, com condições de uso variadas. Devido ao interesse dos consumidores e do setor produtivo no acesso e na oferta de produtos contendo essa substância, a Anvisa, proativamente, avaliou a segurança e a eficácia do constituinte.
Por ser encontrada em alimentos e ter funções metabólicas bem caracterizadas, a melatonina atende a definição de substância bioativa estabelecida no art. 3º da Resolução da Diretoria Colegiada (RDC) 243, de 2018.
Para saber mais sobre a melatonina, clique aqui.
Fonte: Site da ANVISA
Read More
Decisão do STF sobre a constitucionalidade da Lei 13.454/2017 (sobre anorexígenos)
Em vista da decisão do Supremo Tribunal Federal (STF) desta quinta-feira (14/10), que, por sete votos a três, declarou a inconstitucionalidade da Lei 13.454/2017, que autoriza a produção, a venda e o consumo, sob prescrição médica, dos remédios para emagrecer mazindol, anfepramona, femproporex e sibutramina:
A Anvisa vem manifestar publicamente o alcance e a importância da decisão do STF, que reconheceu a necessidade de atuação do regulador sanitário e ponderou sobre os riscos associados à autorização de produtos sem o devido registro sanitário, valorando o dever das instituições de zelar pela proteção à saúde.
Esses medicamentos haviam sido proibidos pela Anvisa ainda em 2011, diante das evidências científicas disponíveis. Para a Agência, a decisão é um reconhecimento da sua competência técnica e legal sobre a avaliação da relação de risco-benefício de medicamentos utilizados no Brasil.
A Anvisa vai tomar conhecimento do inteiro teor da decisão a partir de sua publicação para avaliar a repercussão do resultado do julgamento e verificar a regulamentação vigente e as adequações necessárias nas normas.
A Agência mantém a posição de que os riscos do uso dos três medicamentos (mazindol, anfepramona e femproporex) superam significativamente os seus benefícios. Dessa forma, deverá dar encaminhamento para retomar a vedação sobre o uso e a comercialização dessas substâncias no país.
Até o momento, não há novos dados ou estudos que indiquem uma situação favorável ao uso desses produtos. Desde a sua proibição pela Anvisa, em 2011, nenhum laboratório apresentou estudos clínicos que indicassem alguma relação favorável no uso da anfepramona, do femproporex e do mazindol.
Entenda
Em 2011, a Anvisa retirou do mercado as substâncias inibidoras de apetite do tipo anfetamínicos – mazindol, femproporex e anfepramona. Para essa decisão foram analisados mais de 170 trabalhos científicos e realizadas discussões técnicas, inclusive com outras agências regulatórias do mundo, que naquele momento haviam concluído análises semelhantes.
Ficou comprovado que os três medicamentos citados não apresentavam eficácia, com resultados absolutamente insatisfatórios no médio e longo prazo, além de trazerem efeitos colaterais que incluem risco de dependência, aumento da hipertensão arterial e problemas psiquiátricos, bem como outros danos ao cérebro e ao sistema cardiovascular.
A sibutramina também foi reavaliada em 2011, mas, neste caso, ficou demonstrado que o seu benefício era maior que o seu risco, desde que utilizada adequadamente e para determinados perfis de pacientes.
Diante disse, a Anvisa estabeleceu dose máxima diária, limitação no tempo do tratamento, assinatura de Termo de Responsabilidade pelo médico prescritor e Termo de Ciência do paciente para o uso da substância.
Fonte: Site da ANVISA
Read More
Falhas no sistema de peticionamento de importação de medicamentos
A Anvisa informa que, devido a falhas no sistema de informação ocorridas na segunda quinzena de setembro deste ano, houve tramitação indevida de petições de importação de medicamentos e insumos farmacêuticos para a Unidade de Atendimento ao Público (Uniap). Diante desse erro, as petições secundárias vinculadas ao processo de importação original (aditamentos, cumprimento de exigência, licenciamento substitutivo) são remetidas automaticamente para a caixa da Uniap, não sendo disponibilizadas para análise.
Assim, a Agência orienta que os importadores de medicamentos e insumos farmacêuticos verifiquem na página de consultas da instituição (https://consultas.anvisa.gov.br/#/documentos/) se as petições secundárias protocoladas a partir de 14/9/2021, vinculadas a petições primárias de importação, foram direcionadas para a Uniap. Caso seja constatado o erro, solicitamos que as referidas petições sejam encaminhadas via canais de atendimento (https://www.gov.br/anvisa/pt-br/canais_atendimento), para que sejam devidamente analisadas.
Tal medida objetiva reduzir os atrasos na anuência de processos de importação.
Fonte: Site da ANVISA
Read More
Anvisa não terá atendimento presencial no dia 11 de outubro
A Anvisa informa que, conforme a Portaria ME 11.923/2021, não haverá atendimento presencial na sede da Agência, em Brasília (DF), na segunda-feira (11/10).
Destaca-se que a Central de Atendimento da Anvisa funcionará normalmente nesse dia, entre 7h30 e 19h30, pelo telefone 0800 642 9782.
Além disso, a qualquer momento, o usuário pode registrar o seu pedido de informação por meio do formulário eletrônico Fale Conosco ou pela plataforma Fala.Br. Agradecemos a compreensão de todos!
Fonte: Site da ANVISA.
Read More
Peticionamento de DCBs será realizado de forma eletrônica
Foi publicada no Diário Oficial da União (D.O.U.) desta quarta-feira (6/10) a Resolução da Diretoria Colegiada (RDC) 569/2021, que trata de um novo procedimento para o peticionamento de demandas relacionadas às Denominações Comuns Brasileiras (DCBs). A nova norma, que passará a vigorar a partir de 1º de janeiro de 2022, alterou a RDC 63/2012 e revogou a Instrução Normativa 5/2012, ambas sobre DCBs.
A principal mudança trazida pela RDC 569/2021 consiste na migração do peticionamento de solicitação, alteração ou exclusão de DCBs para o Sistema Eletrônico de Informações (SEI).
O uso desse sistema permitirá o envio de um formulário assinado pelo solicitante e a geração do número do processo, de forma automática e imediatamente após a finalização do protocolo. Com isso, o usuário poderá acompanhar o andamento do pedido, por meio de uma ferramenta chamada Pesquisa Pública SEI, disponível no portal da Anvisa.
Dessa forma, a Agência aprimorou o mecanismo de realização do procedimento, que, atualmente, é realizado com o envio por e-mail de um formulário em arquivo word não assinado, gerando insegurança para o requerente e falta de protocolo de acompanhamento da solicitação.
A Anvisa informa também que o peticionamento eletrônico via SEI pode ser realizado por qualquer pessoa física com cadastro aprovado de usuário externo. Para saber mais informações sobre como fazer esse tipo de acesso, confira as instruções disponíveis na área do SEI no portal.
Para saber mais sobre o assunto, basta você acessar os conteúdos disponíveis nos links abaixo:
- Webinar Anvisa: peticionamento de Denominações Comuns Brasileiras (realizado em 11/2/2021)
- Gravação do webinar
Confira também o voto da diretora relatora Meiruze Sousa Freitas sobre as alterações na RDC 63/2012.
Lista de DCBs
Também foi publicada no D.O.U. desta quarta-feira a RDC 566/2021, que atualiza a lista de DCBs, com a inclusão de 21 novas denominações. A nova lista consolidada pode ser consultada na página do portal da Anvisa dedicada ao assunto. Confira abaixo!

Anvisa otimiza processo de avaliação da importação de produtos derivados de Cannabis por pessoa física
Foi publicada nesta quarta-feira (6/10), a Resolução RDC 570/2021, que altera a RDC 335/2020. O objetivo da medida é reduzir o tempo para aprovação do cadastro e possibilitar que os pacientes tenham acesso mais célere aos produtos derivados de Cannabis para tratamento de saúde.
O texto anterior da RDC 335 já trazia avanços importantes para o acesso da população a produtos derivados da cannabis para tratamento de saúde. No entanto, a crescente demanda por importação desses produtos tem resultado em tempo longo para a manifestação da Anvisa, o que pode impactar em prejuízo à saúde dos pacientes.
A Agência observou um aumento de mais de 2.400% em 6 anos (média de 400% ao ano), com pedidos que passaram de 896 em 2015 para 19.074 pedidos em 2020, e, até meados de setembro de 2021, já houve 22.028 pedidos de importação de produtos derivados de Cannabis por pacientes para fins terapêuticos. Ademais, a pandemia relacionada à Covid-19 agravou o cenário, provocando um aumento ainda maior nos pedidos de importação desses produtos.
A Resolução de Diretoria Colegiada – RDC nº 335, de 24 de janeiro de 2020, define os critérios e os procedimentos para a importação de Produto derivado de Cannabis, por pessoa física, para uso próprio, mediante prescrição de profissional legalmente habilitado, para tratamento de saúde.
Análise simplificada
A nova Resolução estabelece que a aprovação do cadastro ocorrerá mediante análise simplificada no caso dos Produtos derivados de Cannabis constantes em Nota Técnica emitida pela Gerência de Produtos Controlados da Anvisa e publicada no site da Agência. Dessa forma, no ato do cadastramento, será avaliada exclusivamente a regularidade do produto, ou seja, se o produto a ser importado é produzido e distribuído por estabelecimentos devidamente regularizados pelas autoridades competentes em seus países de origem para as atividades de produção, distribuição ou comercialização.
A Anvisa também está trabalhando na atualização dos sistemas, a fim de permitir, em breve, a aprovação automática do cadastro nos casos de produtos constantes em lista pré-definida pela Agência.
Validade da receita
Outra alteração está relacionada ao prazo de validade da prescrição do profissional legalmente habilitado, que passa a ser de 6 meses. No entanto, a norma prevê que a prescrição do produto terá validade indeterminada até a publicação de instrumento normativo editado pelo Ministério da Saúde que reconheça que não mais se configura a situação de Emergência em Saúde Pública de Importância Nacional declarada pela Portaria nº188/GM/MS, de 3 de fevereiro de 2020.
As importações permanecem sujeitas à fiscalização pela autoridade sanitária em portos, aeroportos, fronteiras e recintos alfandegados (PAF) antes de seu desembaraço aduaneiro, sendo necessária a apresentação dos seguintes documentos, a cada importação:
I – formulário de Petição;
II – conhecimento da carga embarcada;
III – fatura comercial;
IV – prescrição do produto;
V – comprovante de endereço do paciente.
Dessa forma, a Resolução nº 570 alterou o procedimento operacional de análise dos pedidos de importação pela Agência, pois a prescrição do produto passará a ser avaliada apenas pela autoridade sanitária em PAF antes de seu Desembaraço Aduaneiro, evitando duplicidade de análise e permitindo maior rapidez na etapa de aprovação do cadastro.
Formulário de solicitação
A Agência reforça que caberá ao solicitante preencher corretamente todos os dados do formulário para cadastro, sob pena da necessidade de cumprimento de exigências sanitárias previamente ao desembaraço aduaneiro do produto. Além do preenchimento correto, a instrução adequada do processo de importação permitirá ainda maior agilidade na liberação dos produtos para os pacientes.
Webinar
Os novos procedimentos serão esclarecidos em Webinar, a ser realizado pela Agência nos próximos dias, oportunidade na qual os pacientes e profissionais de saúde poderão tirar dúvidas sobre a nova Resolução.
A medida representa mais um avanço regulatório da Anvisa e que pretende contribuir para promover e facilitar o acesso dos pacientes à importação de produtos derivados de Cannabis para uso próprio, especialmente no cenário de pandemia enfrentado pelo Brasil.
Fonte: Site da ANVISA
Read More
Anvisa realiza implantação inicial do acesso via Gov.br
A Anvisa informa que implementará, a partir desta quinta-feira (7/10), entre 18h e 22h, a possibilidade de realizar login em alguns de seus sistemas utilizando a integração com o portal Gov.br. Trata-se de uma meta do Plano Digital da Anvisa 2021-2022, que está sendo desenvolvida pela Gerência-Geral de Tecnologia da Informação (GGTIN) da Agência.
Inicialmente, essa modalidade estará disponível para sistemas que utilizam o mecanismo de autenticação da Anvisa, facilmente identificáveis pela tela comum de login, conforme o exemplo abaixo, com destaque para onde poderá ser iniciado o acesso via Gov.Br. Dentre os principais sistemas, podemos destacar os seguintes: Solicita, Sammed, Siptox, Sisgap e Portal de Serviços.
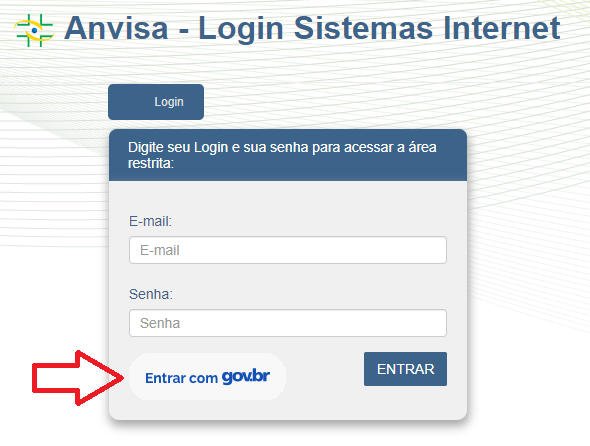
O objetivo é unificar cada vez mais os serviços prestados aos cidadãos, incluindo também os meios de acesso a esses serviços. Maiores detalhes sobre o Gov.br, incluindo o passo a passo para cadastro e as informações necessárias, podem ser encontrados na página https://www.gov.br/governodigital/pt-br/conta-gov-br/conta-gov-br/.
Atenção! O acesso via Gov.br ainda requer que o usuário esteja cadastrado em nossos sistemas, esteja corretamente vinculado às empresas que representa e tenha tido a correta concessão de perfis e permissões pelo gestor de segurança da empresa. As informações necessárias para o cadastro de empresas e usuários junto à Anvisa podem ser obtidas na página https://www.gov.br/anvisa/pt-br/sistemas/cadastros.
Em decorrência dessa implementação, os sistemas Solicita, Sammed, Siptox, Sisgap e Portal de Serviços, entre outros, ficarão indisponíveis temporariamente. A atividade está prevista para ocorrer entre as 18h e as 22h de quinta-feira (7/10). Por fim, destaca-se que alguns sistemas, como o atual portal da Anvisa, o Vigimed, o CIVP e a Declaração de Saúde do Viajante (DSV), não serão afetados pela manutenção e continuarão operando normalmente.
Fonte: Site da ANVISA

Medicamento matriz em adequação não pode ter fármaco clone vinculado
A Anvisa informa às empresas do setor de fármacos que não serão aceitas petições clones relacionadas a medicamentos matriz que estejam em fase de adequação relacionada à comprovação de qualidade, segurança ou eficácia do produto. A regra está descrita no artigo 6º da Resolução da Diretoria Colegiada (RDC) 31/2014.
Sendo assim, serão indeferidas (negadas) as petições de registro de medicamentos clones vinculados a produtos matriz cujo registro foi concedido mediante a apresentação de termo de compromisso.
Petição clone
Um medicamento clone é aquele que possui a mesma linha de produção, mesmo fabricante, mesmos relatórios técnico e clínico e a mesma composição de outro medicamento já registrado junto à Anvisa, denominado matriz. Neste caso, os clones são diferentes apenas em aspectos como nome e rotulagem, por exemplo.
Fonte: Site da ANVISA
Read More
