
NOMEAÇÃO – DIRETOR DA ANVISA
DECRETOS DE 25 DE ABRIL DE 2022
O PRESIDENTE DA REPÚBLICA, no uso da atribuição que lhe confere o art. 84,caput, inciso XIV, da Constituição, e tendo em vista o disposto no art. 10, parágrafo único, da Lei nº 9.782, de 26 de janeiro de 1999, resolve:
NOMEAR
a partir de 25 de julho de 2022, DANIEL MEIRELLES FERNANDES PEREIRA, para exercer o cargo de Diretor da Agência Nacional de Vigilância Sanitária – ANVISA, com mandato até 24 de julho de 2027, na vaga decorrente do término do mandato de Cristiane Rose Jourdan Gomes.
Brasília, 25 de abril de 2022; 201º da Independência e 134º da República.
JAIR MESSIAS BOLSONARO
Marcelo Antônio Cartaxo Queiroga Lopes
Fonte: Diário Oficial da União de 26/04/2022
Read More
Nota Anvisa: vigência do uso emergencial de vacinas e medicamentos
Anvisa está revisando a vigência dos atos editados pela Agência em resposta à pandemia de Covid-19. Estão incluídos entre os atos as resoluções que tratam do uso emergencial de vacinas e medicamentos.
Diversos atos editados de forma excepcional pela Anvisa, em resposta à Covid-19, previam inicialmente o encerramento de sua vigência a partir do fim do estado de Emergência de Saúde Pública de Importância Nacional.
A solicitação feita pelo Ministério da Saúde é que a vigência das normas da Anvisa para a pandemia seja mantida por um ano a partir do momento da retirada do estado de Emergência de Saúde Pública de Importância Nacional. A prorrogação do prazo de vigência das normas ainda depende de aprovação da Diretoria Colegiada da Anvisa e, se aprovada, deve permitir que vacinas e medicamentos em uso emergencial continuem em uso por um ano.
A Anvisa destaca que a vacinação contra Covid-19 deve continuar em andamento e que a dose de reforço deve ser aplicada nos públicos indicados.
É necessário também que a vigilância epidemiológica sobre a doença continue por meio dos programas de testagem e mapeamento genômico do vírus em circulação no Brasil. A medida é necessária diante da possibilidade de surgimento de novas variantes.
Cada pessoa deve continuar atenta às medidas de higienização das mãos e uso de máscara em ambientes de maior risco, com aglomerações.
Vale ressaltar que, apesar dos avanços alcançados no Brasil, muitos países ainda continuam em estado de pandemia e com índices de vacinação ainda baixos, necessitando imunizar suas populações.
Fonte: Site da ANVISA
Read More
Publicado 1º boletim sobre monitoramento pós-mercado
A Anvisa lançou, nesta segunda-feira (4/4), o 1º Boletim Informativo sobre Monitoramento Pós-Mercado de produtos e serviços sujeitos à vigilância sanitária. A publicação inédita é uma produção da Gerência-Geral de Monitoramento de Produtos Sujeitos à Vigilância Sanitária (GGMON) e traz os principais resultados alcançados no processo de acompanhamento realizado por meio do Sistema de Notificação e Investigação em Vigilância Sanitária (Vigipós), ao longo de 2021.
O monitoramento é realizado com base nos dados do Notivisa, uma plataforma criada para receber notificações de eventos adversos e queixas técnicas, sendo o sistema informatizado responsável por operacionalizar o Vigipós. Também foram utilizadas informações de um outro sistema chamado VigiMed, destinado às notificações de eventos adversos relacionados ao uso de medicamentos e vacinas.
Nesta publicação de estreia, o informativo traz dados gerais do monitoramento nacional de alimentos (nutrivigilância); células, tecidos e órgãos doados e transplantados (biovigilância); cosméticos (cosmetovigilância); e dispositivos médicos (tecnovigilância). Também constam informações relacionadas a medicamentos (farmacovigilância); fármacos submetidos a controle especial (vigilância de controlados); ciclo da doação e transfusão de sangue (hemovigilância); e vigilância de saneantes.
A partir desta primeira edição, o Boletim Informativo sobre Monitoramento Pós-Mercado terá periodicidade trimestral e ficará disponível para consulta no portal da Agência.
Confira a íntegra do 1º Boletim Informativo sobre Monitoramento Pós-Mercado.
Fonte: Site da ANVISA
Read More
Consulta de autorização de funcionamento tem novas funcionalidades
A partir desta segunda-feira (28/3), a consulta de Autorização de Funcionamento de Empresa (AFE) e Autorização especial (AE) terá novas funcionalidades.
Também haverá unificação das consultas de Autorização de Farmácias e Drogarias com as demais empresas. Conheça as principais mudanças.
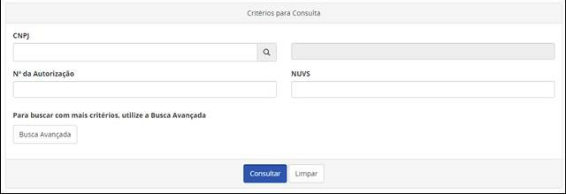
Novidades
Ao clicar em “Busca Avançada”, será possível realizar buscas de empresas por estado, cidade, atividade ou classe da autorização. Na hora de fazer a busca, é importante lembrar que a autorização sempre é concedida no CNPJ da matriz da empresa. As filiais podem exercer as atividades, desde que estejam licenciadas pela Vigilância Sanitária.
Caso a empresa tenha alguma medida cautelar (produto irregular identificado pela Anvisa), essa informação também será exibida. Ao clicar no botão “Medida Cautelar”, o sistema abrirá uma nova aba com o detalhamento da medida.
O mesmo acontece no caso de CBPF (Certificado de Boas Práticas de Fabricação) ou CBPDA (Certificado de Boas Práticas de Distribuição e Armazenagem). Caso a empresa tenha certificados vigentes, as informações também estarão disponíveis.
Uma outra novidade é a possibilidade de exportar para Excel os resultados das buscas, permitindo o tratamento dos dados. A nova consulta também irá disponibilizar o site e o SAC (Serviço de Atendimento ao Consumidor) da empresa. Essas informações poderão ser atualizadas pela empresa direto no Cadastro de Empresas, sem a necessidade de peticionamento ou solicitação junto ao Fale Conosco.

Gases medicinais
Com relação à AFE para gases medicinais, o campo “Área de Produto” irá trazer tanto a opção de medicamentos quanto de gases medicinais.
A numeração de AFE utilizando o filtro de gases medicinais busca apenas as autorizações com iniciais 22. Tendo em vista a o esgotamento da numeração de AFEs iniciadas pelo número 22, algumas autorizações para gases medicinais foram concedidas com a numeração iniciada em 1, disponíveis no filtro de medicamentos.
Fonte: Site da ANVISA
Read More
Sistema de peticionamento de licença de importação apresenta falhas
Devido a falhas no sistema de informação, a Anvisa identificou a ocorrência de petições que, embora protocoladas, não foram disponibilizadas para a área responsável. Diante disso, tais petições podem não ter sido distribuídas para análise, acarretando atraso na anuência.
Sendo assim, a Agência orienta que os importadores de produtos sujeitos à vigilância sanitária com petições protocolizadas com prazo superior a cinco dias úteis e sem manifestação da Anvisa informem os dados de tais processos de importação por meio dos canais de atendimento, para que as petições sejam devidamente analisadas. Tal medida objetiva reduzir possíveis atrasos na anuência de processos de importação.
A Agência agradece a compreensão de todos.
Fonte: Site da ANVISA
Read More
Anvisa adota medidas para garantir a segurança de medicamentos do tipo “sartanas” utilizados no Brasil
A Anvisa vem adotando uma série de medidas após a detecção de impurezas, chamadas de nitrosaminas, nos princípios ativos conhecidos como “sartanas”, como a losartana e a valsartana, utilizados na fabricação de medicamentos para o tratamento de hipertensão arterial (pressão alta).
No ano de 2018, a Anvisa e agências reguladoras em todo o mundo ficaram cientes da presença de nitrosaminas acima dos níveis permitidos em medicamentos da classe das “sartanas”, e adotaram medidas para o controle sanitário desse tipo de impureza.
As nitrosaminas são compostos comumente encontrados na água, em alimentos defumados e grelhados, laticínios e vegetais. Sabe-se que a exposição a esses compostos dentro de limites seguros representa baixo risco de agravos à saúde. No entanto, acima de níveis aceitáveis e por longo período, a exposição às nitrosaminas pode aumentar o risco da ocorrência de câncer.
No Brasil, as ações de controle promovidas pela Anvisa foram iniciadas com inspeções realizadas em 30 empresas fabricantes de medicamentos, nas quais foram inspecionados 111 produtos. Como resultado, 31 ações sanitárias foram efetuadas, incluindo interdições, suspensões e recolhimento de medicamentos.
Em 2019, foi reportada a presença de nitrosaminas em outras classes de medicamentos, como nizatidina, ranitidina e metformina, que por sua vez levou à publicação de suspensões da importação, distribuição, comercialização e uso de determinados produtos.
Em 2020, foi lançado o programa de monitoramento de nitrosaminas, no qual amostras dos medicamentos e dos insumos farmacêuticos ativos losartana e valsartana foram submetidos a análise laboratorial conduzida pelo Instituto Nacional de Controle de Qualidade em Saúde (INCQS), para identificação e quantificação dessas impurezas. Os resultados do programa podem ser observados no painel disponibilizado no portal da Anvisa.
Atualmente, estão em vigor a Resolução da Diretoria Colegiada (RDC) 238/2019, que instituiu a necessidade de o setor produtivo investigar, controlar e eliminar nitrosaminas potencialmente carcinogênicas, e o Guia 50/2021, com recomendações quanto ao controle de nitrosaminas em insumos farmacêuticos ativos (IFAs) e medicamentos.
O recolhimento voluntário é um processo iniciado pela empresa responsável pela regularização do produto junto à Anvisa, em observância ao art. 6º da Lei 6.360, de 23 de setembro de 1976, e à RDC 55/2005. A Anvisa publica no Diário Oficial da União tanto os recolhimentos voluntários, iniciados pelas empresas, quanto os recolhimentos determinados pela própria Agência.
Os recolhimentos, voluntários ou não, se referem sempre a lotes específicos de medicamentos.
Para conferir todas as ações de recolhimento, suspensão e interdição de medicamentos determinadas pela Anvisa, acesse: https://www.gov.br/anvisa/pt-br/assuntos/fiscalizacao-e-monitoramento/consulta-de-produtos-irregulares.
Fonte: Site da ANVISA
Read More
Anvisa e FDA renovam declaração de cooperação técnica
A Anvisa e a Administração de Alimentos e Medicamentos dos Estados Unidos (FDA, do inglês Food and Drug Administration) assinaram uma Declaração de Cooperação visando manter e fortalecer os seus mecanismos de colaboração. Nesta terça-feira (8/3), os signatários representantes das duas agências reuniram-se virtualmente para celebrar a assinatura do documento.
O documento, que substitui declaração anterior, foi negociado entre as duas autoridades para dar continuidade à cooperação já consolidada na área de regulação sanitária, mantendo o intercâmbio de informações técnicas e explorando novas oportunidades de parcerias.
Ao longo da pandemia de Covid-19, as duas agências têm colaborado ativamente na análise de produtos e têm estabelecido uma comunicação contínua.
A Anvisa e a FDA participam dos principais fóruns internacionais relacionados a produtos sujeitos à vigilância sanitária. Ambas as agências são autoridades reguladoras nacionais de referência no âmbito da Organização Pan-Americana da Saúde (Opas), vinculada à Organização Mundial da Saúde (OMS).
Além disso, desde 2020 a Anvisa participa do Projeto Orbis, coordenado pela FDA com a finalidade de agilizar o registro e o acesso a medicamentos oncológicos, por meio de análises conjuntas.
Clique aqui e saiba mais sobre a cooperação internacional da Agência.
Fonte: Site da ANVISA
Read More
Restabelecida funcionalidade do sistema de peticionamento para cadastro de IFAs
A Anvisa informa que foi restabelecida a funcionalidade do sistema de Peticionamento Eletrônico que permite o cadastro de insumos farmacêuticos ativos (IFAs), que a partir de agora está com a operação normalizada.
Com a correção do erro, foram processadas e gravadas nos bancos de dados as informações apresentadas pelas empresas (insumos cadastrados) desde meados de abril de 2021, quando o problema foi detectado.
Assim, solicita-se que as empresas avaliem seus cadastros e revisem as informações, realizando notificações e alterando o cadastro caso identifiquem inconsistências, visto que podem existir informações duplicadas ou obsoletas devido ao tempo decorrido.
Recomenda-se ainda que tal avaliação seja realizada pelas empresas com a maior brevidade possível, em observância às disposições da Resolução da Diretoria Colegiada (RDC) 30/2008, com vistas a evitar possíveis impactos nos processos de importação de IFAs ou de inspeções.
Caso seja identificado novo erro, deve ser acessado o formulário eletrônico Fale Conosco, informando: nome e link do sistema com defeito; navegador e dispositivo usado para acessar o sistema; data e hora aproximada do erro em questão; e perfil específico (gestor de segurança, responsável legal ou usuário regulatório) usado quando ocorreu o erro. Além disso, deve ser incluído, preferencialmente como anexo, o passo a passo para chegar ao erro, isto é, os prints de cada etapa com os dados preenchidos.
Fonte: Site da ANVISA
Read More
Confira as orientações da Anvisa sobre o agendamento pelo sistema Parlatório
Agência orienta que interessados verifiquem a área responsável pelo assunto que se pretende discutir na audiência.
A Anvisa reforça a importância da seleção correta da área responsável pelo assunto que se pretende discutir, no momento da solicitação do agendamento de audiências por meio do sistema Parlatório, em atenção à Portaria 54/2021.
Desde o início da pandemia provocada pelo novo coronavírus, houve um aumento significativo do número de reuniões realizadas pela Anvisa. Contudo verificou-se que muitas dessas reuniões têm sido solicitadas equivocadamente à Gerência Geral de Medicamentos e Produtos Biológicos (GGMED).
De acordo com a referida portaria, somente nos casos em que o assunto envolva mais de uma área técnica ou seja de competência exclusiva da GGMED, o agendamento deve ser feito diretamente com a gerência-geral. A norma prevê ainda que os agendamentos solicitados à alguma área que não seja responsável pelo tema da audiência podem ser recusados.
Sendo assim, a Agência orienta que, em caso de dúvidas, os interessados em agendar as audiências consultem o Regimento interno da Anvisa, que detalha as competências de cada área.
Fonte: Site da ANVISA
Read More

Projeto-piloto de fiscalização de produtos irregulares apresenta os primeiros resultados
O monitoramento é fruto de uma parceria da Anvisa com o PNUD.
A fiscalização de produtos sujeitos à vigilância sanitária vendidos de forma irregular na internet ganhou o reforço de um projeto inovador, idealizado pela Anvisa e pelo Programa das Nações Unidas para o Desenvolvimento (PNUD). Lançada no final do ano passado, a iniciativa tem como objetivo ampliar o monitoramento desses produtos e atuar ostensivamente para reduzir as irregularidades identificadas pela Agência no setor de vendas pela internet.
Mesmo ainda estando em sua fase inicial e sob avaliação da Anvisa, o projeto-piloto dessa ação já conta com resultados preliminares. De acordo com o levantamento, no período de 1º/12/2021 a 10/2/2022 houve a captação de 1 milhão de “sinais” de possíveis focos de monitoramento, com a identificação de mais de 17 mil ameaças em potencial e cerca de 10 mil potenciais irregularidades.

A divulgação dos dados preliminares tem como finalidade dar transparência às informações e ratificar a importância da utilização da inteligência artificial para o alcance das atividades de fiscalização no comércio eletrônico, cumprindo com a missão da Anvisa de proteger e promover a saúde da população, atuando de forma ágil, eficiente e transparente.
Ressalta-se que a utilização de produtos irregulares coloca em risco a saúde dos usuários. Portanto, as ações para coibir a comercialização desses produtos são medidas extremamente importantes para assegurar a proteção da saúde da população.
Como funciona e quais são as etapas do projeto-piloto?
Para executar a ação, a Anvisa conduz uma análise de risco para definição dos termos mais relevantes para utilização nas buscas na internet, considerando produtos irregulares, com o intuito de refinar as pesquisas.
A partir dos termos e de regras preestabelecidas, a ferramenta realiza a busca, identificando os potenciais anúncios irregulares. Identificada a potencial irregularidade, o site é notificado, sendo solicitada a retirada do anúncio do ar.
As notificações são encaminhadas pela ferramenta, de forma automática, pelo e-mail notificacao@anvisa.gov.br. Ao ser notificado, o responsável pelo site pode entrar em contato com a Agência, também por meio do e-mail notificacao@anvisa.gov.br, indicando, na resposta, o número da notificação, para prestar os esclarecimentos necessários e esclarecer eventuais dúvidas.
Dúvidas gerais, que não sejam específicas de notificações recebidas, devem ser enviadas à Anvisa por meio do Fala.BR – Plataforma Integrada de Ouvidoria e Acesso à Informação. Após a notificação, a ferramenta realiza o monitoramento das ações adotadas pelo responsável pelo site, para assegurar que o anúncio foi retirado, bem como para verificar que não houve o retorno ao ar desse mesmo anúncio.
Produtos irregulares
De maneira geral, são considerados irregulares quaisquer produtos que não atendam às regras definidas pela Anvisa e, portanto, não ofereçam à sociedade garantia de eficácia, segurança e qualidade exigida para itens sob vigilância sanitária.
As exigências para regularização variam de acordo com o tipo de produto. O conjunto de itens irregulares inclui, entre outros, produtos sem registro ou notificação na Agência, produtos falsificados, furtados, roubados ou contrabandeados. Também entram nessa categoria os produtos cuja propaganda é considerada inadequada e aqueles que apresentam desvios de qualidade em seu processo de fabricação.
Os produtos proibidos são itens irregulares que foram objeto de publicação de uma Resolução (RE) da Anvisa, estabelecendo a fiscalização de proibição de fabricação, importação, armazenamento, distribuição, comercialização, propaganda, publicidade, promoção e/ou uso, a depender da irregularidade evidenciada.
Já um desvio de qualidade é quando há descumprimento dos parâmetros de qualidade estabelecidos na regularização do produto junto à autoridade sanitária. Por exemplo, no caso de medicamentos, os desvios de qualidade incluem alterações de aspecto, cor, odor, sabor e volume ou a presença de corpo estranho.
Melhorias do projeto-piloto
A Anvisa tem realizado melhorias na condução do projeto-piloto e está trabalhando no aperfeiçoamento da notificação, entre outros pontos, para dar maior segurança aos agentes afetados quanto à autenticidade da notificação recebida.
A Agência informa que está à disposição para quaisquer esclarecimentos que sejam necessários e para corrigir quaisquer falhas detectadas pelos atores envolvidos, por meio do Fala.BR – Plataforma Integrada de Ouvidoria e Acesso à Informação. O extrato do contrato do projeto-piloto foi publicado no Diário Oficial da União n. 22, de 1º de fevereiro de 2022, Seção 3, p. 102.
Plano Estratégico e monitoramento de e-commerce
O fortalecimento das ações de controle, monitoramento e fiscalização de produtos e serviços é um dos objetivos estratégicos da Anvisa e está inserido no Plano Estratégico de 2020-2023. É importante destacar que não houve mudança na atuação da Agência, mas sim uma alteração na capacidade de ação, por permitir um monitoramento ativo mais amplo, devido a ferramentas que possibilitam a ampliação da capacidade de detecção de potenciais irregularidades.
Transparência das ações de fiscalização
Apenas em 2021, foram concluídos mais de 2.500 dossiês de investigação sanitária e foram publicadas mais de 700 medidas preventivas e/ou cautelares referentes à área de fiscalização de medicamentos, insumos farmacêuticos, produtos para a saúde, saneantes, alimentos, cosméticos, produtos de higiene pessoal e perfumes.
Para os interessados em pesquisar essas informações, o portal da Agência conta com uma área exclusiva para a consulta de produtos irregulares, que permite a busca por nome e tipo do produto, bem como pelo número de registro. A Anvisa dispõe, ainda, de uma página dedicada aos Programas de monitoramento analítico, contendo os produtos analisados, os resultados obtidos e as ações adotadas.
Dados adicionais podem ser verificados nos Relatórios de Gestão, que apresentam os resultados anuais do que a Agência produziu e entregou, demonstrando o seu nível de governança, conformidade, eficiência, economicidade e sustentabilidade.
Quanto ao comércio de produtos sujeitos à vigilância sanitária pela internet, a Anvisa realizou um evento virtual, em agosto de 2021, em que foram apresentados e discutidos os regulamentos sanitários vigentes para a correta comercialização de produtos por meio do comércio eletrônico (e-commerce) no país. Também foram discutidas questões relacionadas à fiscalização e à responsabilidade da Agência em relação à prática da venda de produtos sujeitos à vigilância sanitária, bem como aos desafios em relação ao tema.
O debate envolveu a comercialização indevida pela internet de produtos que prometem efeitos não comprovados, ou seja, com alegações não permitidas e que não podem ser alcançadas por meio do uso desses produtos.
Entenda o processo de fiscalização sanitária
As ações de fiscalização são medidas de controle pós-mercado para verificar se os estabelecimentos e produtos comercializados estão de acordo com as regras que constam na legislação sanitária. As possíveis irregularidades podem ser identificadas em programas de monitoramento, durante a realização de atividades programadas ou como resultado da avaliação de denúncias e queixas técnicas.
A fiscalização de produtos sob vigilância sanitária não é realizada apenas pela Anvisa. A Agência atua como coordenadora do Sistema Nacional de Vigilância Sanitária (SNVS), que é composto pelos órgãos de vigilância sanitária dos estados, dos municípios e do Distrito Federal (DF). Assim, a fiscalização é integrada e descentralizada, com responsabilidades compartilhadas entre as três esferas do governo (união, estados e municípios).
Geralmente, a abertura de um processo de investigação sanitária é decorrente de situações que requerem alta prioridade, de forma a minimizar o risco sanitário e o potencial dano à saúde que podem decorrer de possíveis irregularidades cometidas pelo investigado.
Durante a etapa de investigação sanitária, são levantadas informações para que existam subsídios suficientes e robustos para a tomada de decisão mais adequada da autoridade sanitária. No decorrer da investigação, é possível a publicação de medidas preventivas e/ou cautelares, que determinem ações de apreensão, inutilização e proibição de armazenamento, comercialização, distribuição, fabricação, importação, propaganda e do uso, para reduzir, de forma imediata, qualquer risco sanitário decorrente da irregularidade observada, conforme preveem a Lei 6.360/1976 e a Lei 9.782/1999.
Finalizada a etapa de investigação sanitária, quando há evidências suficientes para confirmar a suspeita, mediante a identificação, dentre outros fatores, da materialidade dos fatos da infração sanitária, da autoria, da identificação da conduta irregular e seu enquadramento na legislação e do risco sanitário da potencial infração, é iniciado o Processo Administrativo Sanitário (PAS), observados os requisitos, rito e prazos dispostos na Lei 6.437/1977.
Caso seja constatada a infração sanitária e instaurado o PAS, antes da aplicação de penalidade é sempre garantido, conforme a legislação vigente, o devido processo legal, incluindo ampla defesa.
Caso seja constatada a infração sanitária e instaurado o PAS, antes da aplicação de penalidade é sempre garantido, conforme a legislação vigente, o devido processo legal, incluindo ampla defesa. Como já afirmado acima, reitera-se que a Anvisa se empenha em concluir as investigações sanitárias para que seja adotada a decisão mais adequada, minimizando o risco sanitário e o potencial dano à saúde que podem decorrer de possíveis irregularidades cometidas pelos investigados.
Destaca-se que no processo de investigação, quando é identificado indício de atividade ilícita que possa configurar infração prevista na legislação penal, outras esferas são informadas, como, por exemplo, o Ministério Público, já que a esfera criminal está fora do escopo de atuação da Anvisa.
Fonte: Site da ANVISA
Read More
